【生命科学部】tRNAの糖修飾がタンパク質合成速度を調節することを明らかにしました
2023.11.22
本研究は、科学雑誌『Cell』(11月21日付:日本時間11月22日)に掲載されました。
背景
研究成果
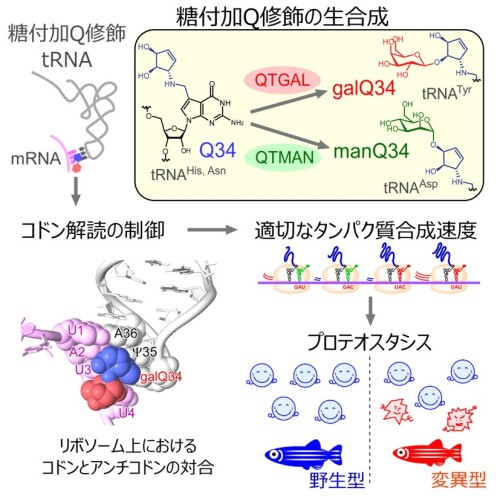
次に、理化学研究所の岩崎信太郎主任研究員らと共同で、QTGALおよびQTMANの遺伝子破壊株のリボソームプロファイリング(注4)を行い、糖付加Q修飾は適切なコドン(注5)解読速度を調節する役割があることを見出しました。糖付加Q修飾による適切な翻訳速度の調節はプロテオスタシス(注6)の維持に重要な役割を担っていることも明らかになりました。理化学研究所の白水美香子チームリーダーらと共同で、クライオ電子顕微鏡(注7)を用いてヒトリボソームとtRNAの複合体の立体構造を解明し、糖付加Q修飾がコドン解読を制御する分子基盤を明らかにしました。
さらに、京都産業大学生命科学部先端生命科学科の三嶋雄一郎准教授らとの共同研究により、QTGALおよびQTMANの欠損したゼブラフィッシュの変異体を作成し、その表現型の解析から、糖付加Q修飾が欠損すると生後の生育が遅れるという興味深い知見を得ました。また、糖付加Q修飾の欠損は統合的ストレス応答(Integrated Stress Response)(注8)を引き起こすこともわかりました。
本研究の意義と今後の展望
以上の結果から、tRNAの糖付加Q修飾は適切な翻訳速度を調節することでプロテオスタシスを維持し、個体の正常な生育に寄与することがわかりました。本研究は、ユニークなtRNA修飾の生合成と機能の研究から、遺伝暗号の解読機構を明らかにした重要な研究成果です。また本成果を利用することで、将来的に、tRNAの機能を調節することにより、創薬にも応用できる可能性があります。
詳細は東京大学・理化学研究所・京都産業大学の共同プレスリリースをご覧ください。
補足・用語説明
(注1)tRNA
Transfer RNA(転移RNA)。タンパク質合成において、コドンとアミノ酸を対応させるアダプター分子として働く。70〜90塩基長の短い一本鎖RNAで、二次構造としては特徴的なクローバー葉様構造をとり、それが折りたたまれてL字型の立体構造を取る。tRNAは3’末端に対応するアミノ酸を受容し、20種類のアミノ酸に対応して異なるtRNA種が存在する。tRNAはコドンと対合するアンチコドンを持ち、リボソーム上でmRNA(伝令RNA)上のコドンと結合することで、対応するアミノ酸を伸長中のタンパク質へと導入する。
(注2)キューオシン(Q)修飾
tRNAのアンチコドン1字目に存在する転写後修飾の一種で、1970年代に西村暹(すすむ)博士らの研究グループによって発見され、化学構造が決定された。
(注3)糖ヌクレオチド
細胞内のメタボライトであり、さまざまな糖転移反応における糖の供与体として用いられる。UDPガラクトースおよびGDPマンノースはそれぞれガラクトースとマンノースの転移に使用される。
(注4)リボソームおよびリボソームプロファイリング
リボソームはRNAとタンパク質からなる複合体でタンパク質合成の場である。大小2つのサブユニットからなり、大サブユニットはペプチジル転移反応を、小サブユニットはmRNAとtRNA間のコドンーアンチコドン対合を監視するといった重要な役割を持つ。リボソームプロファイリングは細胞や組織から翻訳途中のリボソームを抽出し、リボソームと結合しているmRNAの配列を同定することにより、どの遺伝子がどの程度の効率で翻訳されているかを知る解析法。コドンごとに翻訳の速度を見積もることが可能である。
(注5)コドン
遺伝暗号の基本単位。RNAの4種類の塩基が3つ組になり、64通りのコドンが定義される。このうち61個のコドンはタンパク質を構成する20種類のアミノ酸に対応し、3個のコドンがタンパク質合成の終結を指定する。この記事で登場するUAUとUACコドンはチロシンを指定し、GAUとGACコドンはアスパラギン酸を指定している。
(注6)プロテオスタシス
タンパク質が翻訳されてフォールディングをして、機能してから、最終的に分解される過程におけるタンパク質の恒常性。タンパク質合成の適切な翻訳速度の調節が新生タンパク質の正しいフォールディングと健全なプロテオスタシスに必要であることが知られている。
(注7)クライオ電子顕微鏡
生体分子の試料に低温下(約-200℃)で電子線を照射し、その構造を観察できる電子顕微鏡。試料を水溶液中で瞬間凍結することで、生体内に近い環境で目的分子の構造解析を行うことができる。
(注8)統合的ストレス応答(integrated stress response)
細胞が、ウイルス感染、小胞体ストレス、栄養飢餓、ヘム欠乏などのストレスにさらされた際に、リン酸化酵素が活性化され、翻訳開始因子の1つであるeIF2α(eukaryotic translation initiation factor 2α)をリン酸化することにより、キャップ依存的な翻訳開始反応が阻害されるという進化的に保存された細胞内シグナル伝達経路。
論文情報
| 論文タイトル | Glycosylated queuosines in tRNAs optimize translational rate and post-embryonic growth |
|---|---|
| 掲載誌 | Cell |
| 掲載日 | 2023年11月21日付:日本時間11月22日 |
| 研究体制 | 東京大学、理化学研究所、京都産業大学の共同研究 |
| 著者 | Xuewei Zhao*1, Ding Ma*1, Kensuke Ishiguro*1, Hironori Saito*1,2, Shinichiro Akichika*1, Ikuya Matsuzawa*1, Mari Mito*2, Toru Irie*3, Kota Ishibashi*3, Kimi Wakabayashi*3, Yuriko Sakaguchi*1, Takeshi Yokoyama*2, Yuichiro Mishima*3, Mikako Shirouzu*2, Shintaro Iwasaki*2, Takeo Suzuki*1, and Tsutomu Suzuki*1 *1 東京大学、*2 理化学研究所、*3 京都産業大学 |
| DOI | 10.1016/j.cell.2023.10.026 |
謝辞
本研究は、日本学術振興会(JSPS)、日本医療研究開発機構(AMED)、科学技術振興機構(JST)などの支援を受けて実施されました。
