tRNA の糖修飾がタンパク質合成速度を調節する
本件のポイント
- タンパク質合成に重要な役割を担うtRNA に糖(ガラクトースおよびマンノース)を付加する酵素を2 種類同定。
- tRNA の糖付加修飾は適切な翻訳速度の調節を担うこと、またその分子基盤を明らかにした。
- これらのtRNA修飾の欠損はタンパク質の恒常性(プロテオスタシス)の異常を引き起こし、脊椎動物の正常な生育を妨げることが明らかとなった。
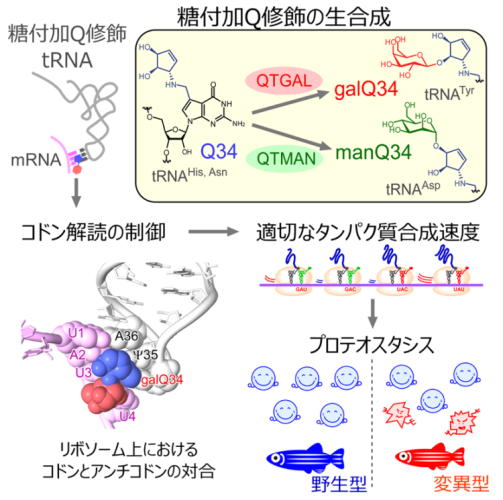 tRNAの糖付加キューオシン(Q)修飾が適切な翻訳速度を調節し正常なプロテオスタシスを保つ
tRNAの糖付加キューオシン(Q)修飾が適切な翻訳速度を調節し正常なプロテオスタシスを保つ
研究の概要
東京大学大学院工学系研究科の鈴木勉教授と鈴木健夫講師(研究当時、現:琉球大学医学部教授)の研究グループは、哺乳動物tRNA※1のキューオシン(Q)修飾※2に糖(ガラクトースおよびマンノース)を付加する2 種類の酵素、QTGAL およびQTMAN を同定しました。研究グループはQTGAL およびQTMAN の組換えタンパク質を取得し、生化学的な解析から、糖ヌクレオチド※3を基質とするtRNA の糖付加Q 修飾反応を再構成しました。また酵素の特徴から立体化学選択的な糖転移のしくみを明らかにしました。さらに速度論的な解析から、糖付加Q 修飾が細胞内の糖ヌクレオチドの濃度によって制御される可能性を見出しました。次に、理化学研究所の岩崎信太郎主任研究員らと共同で、QTGAL およびQTMAN の遺伝子破壊株のリボソームプロファイリング※4を行い、糖付加Q 修飾は適切なコドン※5解読速度を調節する役割があることを見出しました。糖付加Q 修飾による適切な翻訳速度の調節はプロテオスタシス※6の維持に重要な役割を担っていることも明らかになりました。理化学研究所の白水美香子チームリーダーらと共同で、クライオ電子顕微鏡※7を用いてヒトリボソームとtRNA の複合体の立体構造を解明し、糖付加Q 修飾がコドン解読を制御する分子基盤を明らかにしました。さらに、京都産業大学生命科学部先端生命科学科の三嶋雄一郎准教授らとの共同研究により、QTGAL およびQTMAN の欠損したゼブラフィッシュの変異体を作成し、その表現型の解析から、糖付加Q 修飾が欠損すると生後の生育が遅れるという興味深い知見を得ました。また、糖付加Q 修飾の欠損は統合的ストレス応答(Integrated Stress Response)※8を引き起こすこともわかりました。以上の結果から、tRNA の糖付加Q 修飾は適切な翻訳速度を調節することでプロテオスタシスを維持し、個体の正常な生育に寄与することがわかりました。本成果は、ユニークなtRNA 修飾の生合成と機能の研究から、遺伝暗号の解読機構を明らかにした重要な研究成果です。また本成果を利用することで、将来的に、tRNA の機能を調節することにより、創薬にも応用できる可能性があります。
研究の背景
tRNAにはさまざまな化学修飾が含まれており、これらはタンパク質合成を行うために重要な役割を担っています。tRNA修飾の欠損はさまざまなヒトの疾患の原因となることから、tRNA修飾の生理的機能が注目されています。特に、tRNAのアンチコドン領域(34-36位)に見られる修飾は、tRNAがmRNA上のコドンを読み取る能力を付与することで、正確かつ効率的なタンパク質合成を可能にしています。Qは7デアザプリン骨格およびシクロペンテン環※9を持ったグアノシンの誘導体でバクテリアからヒトに至る多くの生物に見られるtRNA修飾です(図1)。
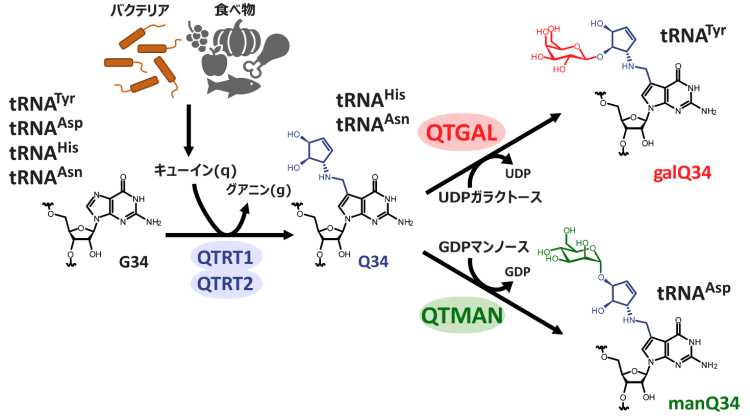 図1:キューオシン(Q)および糖付加Qの生合成
図1:キューオシン(Q)および糖付加Qの生合成
ヒトや脊椎動物はQの塩基部分であるキューイン(q)
※10を生合成することができませんが、バクテリアはqを生合成するため、ヒトは腸内細菌が合成したqや食物から栄養素として摂取したqを体内に取り込み、tRNAのQ修飾に利用しています(図1)。この反応は塩基の付け替えを触媒する酵素QTRT1とQTRT2によって触媒されます。ヒトや脊椎動物は、4種類の細胞質tRNAがQ修飾を持っていますが、このうち、チロシン(Tyr)に対応するtRNATyrではQにガラクトースが付加されたガラクトシルキューオシン(galQ)に変換され、一方でアスパラギン酸(Asp)に対応するtRNAAspではQにマンノースが付加されたマンノシルキューオシン(manQ)に変換されることが知られています(図1)。galQやmanQは1976年に西村暹(すすむ)博士らの研究グループによって発見され、tRNA修飾の中で糖が付与された稀有な修飾体として興味深い研究対象として知られてきましたが、その生合成や機能は約半世紀もの間、謎に包まれていました。
研究の内容
趙雪薇(Xuewei Zhao)大学院生(研究当時)はラット肝臓の抽出液から、複数のカラムクロマトグラフィー※11を用いた生化学的な手法により、tRNATyrのQ修飾にガラクトースを転移する酵素を同定し、キューオシンtRNAガラクトース転移酵素(QTGAL)と命名しました(図1)。また、馬丁(Ding Ma)大学院生(研究当時)はブタ肝臓の抽出液を分画し、tRNAAspのQ修飾にマンノースを転移する酵素を同定し、キューオシンtRNAマンノース転移酵素(QTMAN)と命名しました(図1)。QTGALとQTMANは、それぞれUDPガラクトースおよびGDPマンノースを基質として、galQとmanQを生合成することがわかりました(図1)。糖転移反応は糖のC1炭素の立体配座がα配座からβ配座へと反転する場合と、α配座のまま保持される場合があります(図2)。QTGALは糖転移酵素のGT-Aフォールドを持つGT2ファミリー※12に属し、Qのシクロペンテン環の11位の水酸基にUDPガラクトースのC1炭素をSN2型の求核置換攻撃※13させることで、C1炭素の立体配座がβ配座へと反転しgalQが生成します(図2)。一方で、QTMANはGT-Bフォールドを持つGT4ファミリーに属し、保持型の糖転移反応を触媒することで、Qのシクロペンテン環の12位の水酸基にα配座のままマンノースが転移し、manQを生成します(図2)。QTMANによる酵素反応の速度論的な解析から、GDPマンノースに対するミカエリスーメンテン定数(Km値)※14が69μMと比較的高く、細胞内のGDPマンノース濃度(0.9-11μM)を考慮すると、QTMANによるmanQ生成反応は細胞内のGDPマンノースの濃度で調節させている可能性が示唆されました。
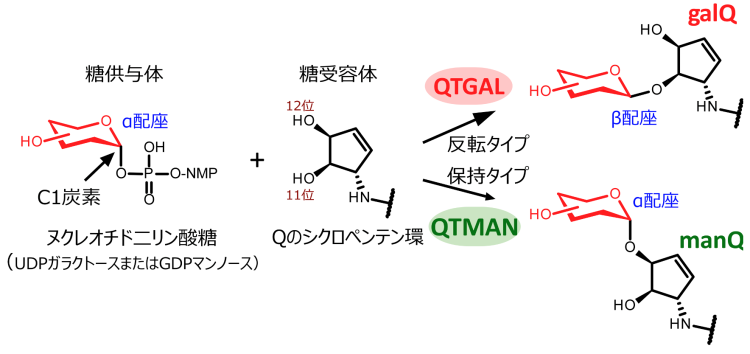 図2:糖付加の異なる2つの反応機構
図2:糖付加の異なる2つの反応機構
また、研究グループはQTGALとQTMANそれぞれの遺伝子を破壊したヒトの培養細胞(QTGAL KOおよびQTMAN KO)を作成し、これらのKO細胞から精製したtRNAにはgalQおよびmanQがそれぞれ完全に消失することを確認しました。次に、研究グループは理化学研究所の岩崎信太郎主任研究員らと共同で、リボソームプロファイリングを行ったところ、QTGAL KO細胞では、tRNA
Tyrが読むコドンのうちUACコドンの翻訳速度が速くなり(図3A)、QTMAN KO細胞ではtRNA
Aspが読むGACとGAUコドンの翻訳速度が速くなることが判明しました(図3B)。Q修飾はリボソームの翻訳速度を速めることから、Qの糖付加修飾は早すぎる翻訳速度を制御する役割があることがわかりました。また、tRNA
Tyrは稀(まれ)にUAGとUAAの終止コドンを読み飛ばす働きがあることから、KO細胞にレポーター遺伝子を導入し、読み飛ばしの効率を測定したところ、galQのガラクトース付加修飾に終止コドンの読み飛ばしを防ぐ役割があることがわかりました(図3C)。次に、レポータータンパク質の凝集度を計測したところ、いずれのKO細胞においても凝集したタンパク質が蓄積したことから(図3D)、糖付加Q修飾はプロテオスタシスの維持に重要な役割を担っていることがわかりました。一般に、適切な翻訳速度の調節は新生タンパク質の正しい折りたたみ(フォールディング)と健全なプロテオスタシスに必要であることが知られています。したがって、糖付加Q修飾は適切な翻訳速度を調節することで、プロテオスタシスの維持に重要な役割を担っていると考えられます。
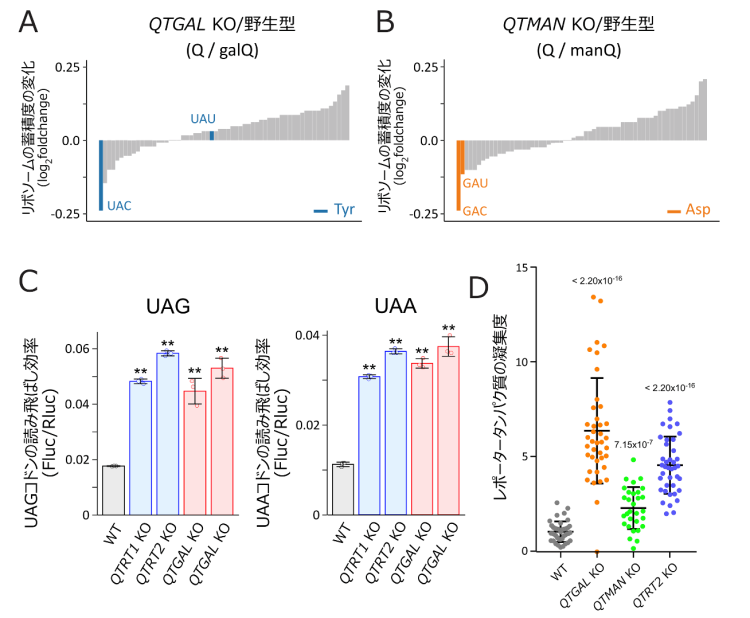 図3:糖付加Q修飾はタンパク質合成速度の調節および終止コドンの読み飛ばしを防ぎ、プロテオスタシスの維持に貢献している
図3:糖付加Q修飾はタンパク質合成速度の調節および終止コドンの読み飛ばしを防ぎ、プロテオスタシスの維持に貢献している
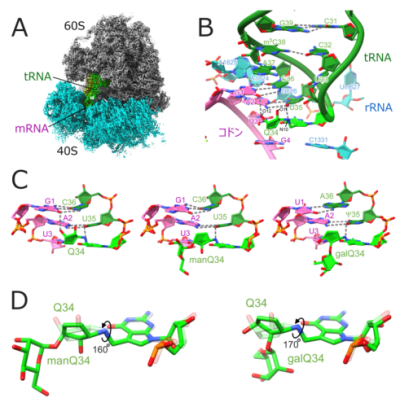 図4:糖付加Q修飾はコドン-アンチコドン対合の主溝に結合する
図4:糖付加Q修飾はコドン-アンチコドン対合の主溝に結合する
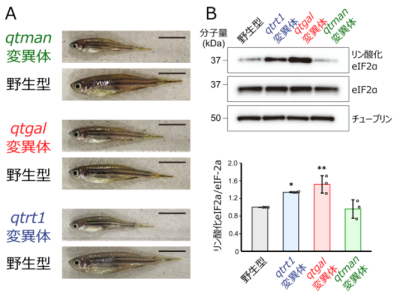 図5:糖付加Q修飾はゼブラフィッシュの健全な生育に必要であり、その欠損は統合的ストレス応答を発動させる(魚の遺伝子名は小文字のイタリック体で示す)
図5:糖付加Q修飾はゼブラフィッシュの健全な生育に必要であり、その欠損は統合的ストレス応答を発動させる(魚の遺伝子名は小文字のイタリック体で示す)
次に、理化学研究所の白水美香子チームリーダーらと共同で、リボソームとtRNA複合体の構造解析を行いました。石黒健介訪問研究員(研究当時、現:東京大学特任助教)はヒト細胞から精製したリボソームに修飾状態の異なるtRNAを結合させて、クライオ電子顕微鏡を用いた構造解析を行いました(図4AB)。その結果、Q修飾のシクロペンテン環は水素結合を介してコドン—アンチコドン対合が形成する二重らせんの主溝に結合し、主溝結合基(major groove binder)※15として機能することで、コドン認識の効率を上げていることが明らかになりました(図4C)。特にこの効果はコドン3字目がUを持つ、UAUやGAUコドンの際に効果が高いこともわかりました。一方で、Qの糖付加は、シクロペンテン環を回転させることでこの効果を弱めることが判明しました(図4D)。以上の構造生物学的な知見は、糖付加Q修飾が適切な翻訳速度を調節するという機能を、分子レベルでわかりやすく説明しています。
さらに京都産業大学の三嶋雄一郎准教授らは、ゼブラフィッシュを用いて、qtgalおよびqtmanのノックアウト系統を作成しました。これらの変異体は正常に胚発生しますが、野生型と比較して生後の成長速度が顕著に遅く、体長が短いという表現型を示しました(図5A)。さらにqtgal KO系統では、eIF2αのリン酸化※16が顕著に亢進していることが判明しました(図5B)。これは、適切な翻訳速度が乱れたことにより、タンパク質のフォールディング異常を検知し、統合的ストレス応答が作動していることを示唆しています。
以上の結果から、糖付加Q修飾はゼブラフィッシュの健全な生育に必要であることが判明しました。
今後の展望
本研究により、糖付加Q 修飾が適切な翻訳速度を調節することで、プロテオスタシスを維持し、健全な生理機能の発現に貢献することが明らかになりました。この成果は、遺伝暗号の解読という生命の根源に関わる古典的な命題を解き明かしたという点で画期的であると言えます。UDP ガラクトースやGDP マンノースなどの糖ヌクレオチドは細胞の栄養状態やストレス環境下で変動することが知られています。特に、速度論的解析から、QTMAN によるmanQ 修飾反応は細胞内のGDP マンノースの濃度変化に影響を受ける可能性が示唆されました。また、糖代謝の異常に起因する各種疾患においても、糖付加Q 修飾が影響を受けることが発症のひとつの原因となっている可能性もあります。今後は糖付加Q 修飾が担う、より詳細な生理機能を明らかにするために、ノックアウトマウスの解析を進める予定です。また、tRNA は創薬における新しいモダリティとして注目されています。本研究成果は将来的に、tRNA の機能を調節するためのツールとしても利用できる可能性を秘めています。
発表者・研究者等情報
東京大学大学院工学系研究科化学生命工学専攻
鈴木 勉 教授
鈴木 健夫 (研究当時:講師)現:琉球大学医学部 教授
石黒 健介 特任助教 (研究当時:理化学研究所 訪問研究員)
理化学研究所
岩崎 信太郎 主任研究員
白水 美香子 チームリーダー
京都産業大学生命科学部先端生命科学科
三嶋 雄一郎 准教授
論文情報
| 雑誌名 |
Cell |
| 題名 |
Glycosylated queuosines in tRNAs optimize translational rate and post-embryonic growth |
| 著者名 |
Xuewei Zhao+, Ding Ma+, Kensuke Ishiguro+, Hironori Saito, Shinichiro Akichika, Ikuya Matsuzawa, Mari Mito, Toru Irie, Kota Ishibashi, Kimi Wakabayashi, Yuriko Sakaguchi, Takeshi Yokoyama, Yuichiro Mishima, Mikako Shirouzu, Shintaro Iwasaki, *Takeo Suzuki, and *Tsutomu Suzuki(+These authors contributed equally) |
| DOI |
10.1016/j.cell.2023.10.026 |
研究助成
本研究は、基盤研究(S)「RNA エピジェネティックスと高次生命現象」(代表:鈴木勉、26220205)、基盤研究(S)「RNA 修飾の変動と生命現象」(代表:鈴木勉、18H05272)、新学術領域研究 研究領域提案型「ncRNA のケミカルタクソノミ」(代表:鈴木勉、26113003)、若手研究(A)「希少RNA 修飾はなぜ存在するのか?ヒトにおける役割から探る」(代表:鈴木健夫、26702035)、基盤研究(B)希少なRNA 修飾の機能究明と動的調節機構の提唱(代表:鈴木健夫、18H02094)、基盤研究(B)ヒトに特有な希少RNA 修飾の分子・生理機能の探求(代表:鈴木健夫、22H02208)、および科学技術振興機構(JST)の戦略的創造研究推進事業(ERATO)「鈴木RNA 修飾生命機能プロジェクト」(研究総括:鈴木勉、JPMJER2002)などの支援を受けて実施されました。
用語・事項の解説
※1 tRNA:Transfer RNA(転移RNA)。タンパク質合成において、コドンとアミノ酸を対応させるアダプター分子として働く。70〜90 塩基長の短い一本鎖RNA で、二次構造としては特徴的なクローバー葉様構造をとり、それが折りたたまれてL 字型の立体構造を取る。tRNA は3’末端に対応するアミノ酸を受容し、20 種類のアミノ酸に対応して異なるtRNA 種が存在する。tRNA はコドンと対合するアンチコドンを持ち、リボソーム上でmRNA(伝令RNA)上のコドンと結合することで、対応するアミノ酸を伸長中のタンパク質へと導入する。
※2 キューオシン(Q)修飾:tRNA のアンチコドン1 字目に存在する転写後修飾の一種で、1970 年代に西村暹すすむ博士らの研究グループによって発見され、化学構造(※9 図参照)が決定された。
※3 糖ヌクレオチド:細胞内のメタボライトであり、さまざまな糖転移反応における糖の供与体として用いられる。UDP ガラクトースおよびGDP マンノースはそれぞれガラトースとマンノースの転移に使用される。
※4 リボソームおよびリボソームプロファイリング:リボソームはRNA とタンパク質からなる複合体でタンパク質合成の場である。大小2 つのサブユニットからなり、大サブユニットはペプチジル転移反応を、小サブユニットはmRNA とtRNA間のコドンーアンチコドン対合を監視するといった重要な役割を持つ。リボソームプロファイリングは細胞や組織から翻訳途中のリボソームを抽出し、リボソームと結合しているmRNA の配列を同定することにより、どの遺伝子がどの程度の効率で翻訳されているかを知る解析法。コドンごとに翻訳の速度を見積もることが可能である。
※5 コドン:遺伝暗号の基本単位。RNA の4種類の塩基が3 つ組になり、64 通りのコドンが定義される。このうち61 個のコドンはタンパク質を構成する20 種類のアミノ酸に対応し、3 個のコドンがタンパク質合成の終結を指定する。この記事で登場するUAU とUAC コドンはTyr を指定し、GAUとGAC コドンはAsp を指定している。
※6 プロテオスタシス:タンパク質が翻訳されてフォールディングをして、機能してから、最終的に分解される過程におけるタンパク質の恒常性。タンパク質合成の適切な翻訳速度の調節が新生タンパク質の正しいフォールディングと健全なプロテオスタシスに必要であることが知られている。
※7 クライオ電子顕微鏡:生体分子の試料に低温下(約-200℃)で電子線を照射し、その構造を観察できる電子顕微鏡。試料を水溶液中で瞬間凍結することで、生体内に近い環境で目的分子の構造解析を行うことができる。
※8 統合的ストレス応答(integrated stress response):細胞が、ウイルス感染、小胞体ストレス、栄養飢餓、ヘム欠乏などのストレスにさらされた際に、リン酸化酵素が活性化され、翻訳開始因子の1 つであるeIF2α(eukaryotic translationinitiation factor 2α)をリン酸化することにより、キャップ依存的な翻訳開始反応が阻害されるという進化的に保存された細胞内シグナル伝達経路。
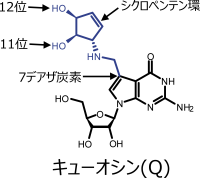 キューオシン(Q)
キューオシン(Q)
※9 7デアザプリン骨格およびシクロペンテン環:Qの塩基(キューイン)はグアノシンの誘導体であるが、グアノシンの7位の窒素が炭素に置換された7デアザプリンになっている(右図参照)。さらに7位の炭素から側鎖が伸び、シクロペンテン環と呼ばれる5員環が特徴的な側鎖として結合している(右図参照)。
※10 キューイン(q):Qの塩基部分(右図参照)の名称。
※11 カラムクロマトグラフィー:筒状の容器にさまざまな性質の充填剤をつめ、そこに適切な溶媒と共に細胞抽出液を流し、タンパク質ごとに充填剤との親和性や分子量の差異などを利用して分離を行う精製法のひとつ。
※12 GT-Aフォールド、GT2ファミリー:ヒトのゲノムには230種類の糖転移酵素がコードされており、これらは45種類のファミリーに分類される。GT2やGT4ファミリーはこの中に含まれる。タンパク質の構造から糖転移酵素はGT-A、GT-B、GT-Cと呼ばれる3種類に分類され、このうちGT-AおよびGT-Bフォールドを持つ糖転移酵素は糖ヌクレオチドを用いることが知られている。
※13 SN2型の求核置換攻撃:有機化学における反応の一種で、求核剤が反応の中心となる求電子剤に対して求核攻撃し、脱離基が脱離する反応。この際に求核剤が炭素原子に対して、脱離基の背面から攻撃するため、生成物の立体化学が反転する。本研究では、Qのシクロペンテン環の水酸基が求核剤であり、糖ヌクレオチドのC1炭素に求核攻撃することで、糖がシクロペンテン環に転移し、ヌクレオチド二リン酸が脱離する。したがって、C1炭素の立体がα配座からβ配座に反転する。
※14 ミカエリスーメンテン定数(Km値):酵素反応速度論において、基質濃度と反応速度を記述する関数で使用する定数。一般にKm値といい、最大反応速度の半分の値を与える基質濃度である。便宜的には酵素と基質の親和性の指標として使用され、Km値が小さいほど、酵素と基質の親和性が高い。
※15 主溝結合基(major groove binder):コドン—アンチコドン対合で形成されるRNAの二重らせんの主溝(メジャーグルーブ)に結合する部位(シクロペンテン環)をこのように表現している。
※16 eIF2αのリン酸化:統合的ストレス応答によって活性化されたリン酸化酵素が翻訳開始因子であるeIF2αをリン酸化することでキャップ依存的な翻訳開始反応が阻害される。
- お問い合わせ先
-
京都産業大学 広報部
〒603‐8555 京都市北区上賀茂本山
Tel.075-705-1411
kouhou-bu@star.kyoto-su.ac.jp







