液胞型のプロトンポンプタンパク質(V-ATPase) の機械的な活性調節機構を解明
2020.07.13
横山 謙 教授らのグループは、クライオ電子顕微鏡を用いた構造解析により、回転分子モータータンパク質であるV-ATPaseの機械的な回転調節機構を明らかにしました。この研究成果は、『eLife』 電子版に掲載されました。
研究概要
V-ATPase は、ATPを燃料とした回転運動によりプロトンを輸送し、オルガネラ内を酸性化することで、多くの重要な生命活動を支えるタンパク質です。横山 謙 教授、岸川 淳一 助教(現大阪大学)らのグループは、最近目覚ましい発展をとげているクライオ電子顕微鏡により、V-ATPase の VO部分の詳細な構造を明らかにしました。親水性であるV1部分が脱離し、残されたVO部分でのプロトンの漏洩がなんらかの機構で妨げられていることが言われていました。今回の研究成果により、プロトンの漏洩阻害が、親水的な腕部分の大きな構造変化による回転阻害によって起こることがわかりました。このような機械的な活性調節機構をタンパク質が備えているのは驚きであり、いかに精緻で精巧な仕組みでタンパク質が生命を支えているかを改めて認識できました。
研究の背景
私達の細胞の中には、イオンの流れで生じた回転力を利用して生命のエネルギー通貨であるATPを合成したり、反対にATPを燃料として回転し、イオンを輸送するタンパク質が存在します。これらは、回転することで機能することから、回転分子モータータンパク質ともよばれ、中心回転軸の回転により、ATPの合成もしくは加水分解と、膜部分でのイオンの輸送が共役(同時に起こること)します。
回転分子モータータンパク質である液胞型 ATP分解酵素 V-ATPase は、リソゾームやエンドソームといった酸性オルガネラ小胞の膜に存在し、小胞内部を酸性化することで、蛋白質の品質管理や神経伝達、免疫反応などを支える最も重要なプロトンポンプ蛋白質です。水溶性のV1部分においてATPを分解して起こった中心軸タンパク質の回転を、膜内在性の VO部分に伝え、VO部分のリング複合体タンパク質を回転させることで、効率よくプロトンを輸送します。
V-ATPase の活性は、細胞内の状態に応じて調節されています。V-ATPase の調節機構としてよく知られているものに、V1部分の可逆的な脱着機構があります。細胞内の栄養状態が悪くなり、ATPの分解を抑えたほうが良い時に、V1部分がVO部分から離れ、脱離したV1部分はATPを分解する活性を失います。この時、VO部分からプロトンがもれないような仕組みが働くことが知られていましたが、その分子機構はよくわかっていませんでした。
クライオ電子顕微鏡によるタンパク質の構造解析(分子の形を明らかにすること)技術は、近年急速に発達し、数多くの創薬の標的タンパク質の構造が発表されています。身近なところでは、新型コロナウイルスが高い感染力を持つ仕組みや、抗新型コロナウイルス薬開発に役立つ構造情報が明らかにされ、今後の創薬やワクチン開発に期待が持たれます。私達は、いち早くクライオ電子顕微鏡による構造解析法に着目し、国内では最初となる 膜タンパク質複合体(V/A-ATPase)の高分解能構造を発表しました(参考文献1)。
回転分子モータータンパク質である液胞型 ATP分解酵素 V-ATPase は、リソゾームやエンドソームといった酸性オルガネラ小胞の膜に存在し、小胞内部を酸性化することで、蛋白質の品質管理や神経伝達、免疫反応などを支える最も重要なプロトンポンプ蛋白質です。水溶性のV1部分においてATPを分解して起こった中心軸タンパク質の回転を、膜内在性の VO部分に伝え、VO部分のリング複合体タンパク質を回転させることで、効率よくプロトンを輸送します。
V-ATPase の活性は、細胞内の状態に応じて調節されています。V-ATPase の調節機構としてよく知られているものに、V1部分の可逆的な脱着機構があります。細胞内の栄養状態が悪くなり、ATPの分解を抑えたほうが良い時に、V1部分がVO部分から離れ、脱離したV1部分はATPを分解する活性を失います。この時、VO部分からプロトンがもれないような仕組みが働くことが知られていましたが、その分子機構はよくわかっていませんでした。
クライオ電子顕微鏡によるタンパク質の構造解析(分子の形を明らかにすること)技術は、近年急速に発達し、数多くの創薬の標的タンパク質の構造が発表されています。身近なところでは、新型コロナウイルスが高い感染力を持つ仕組みや、抗新型コロナウイルス薬開発に役立つ構造情報が明らかにされ、今後の創薬やワクチン開発に期待が持たれます。私達は、いち早くクライオ電子顕微鏡による構造解析法に着目し、国内では最初となる 膜タンパク質複合体(V/A-ATPase)の高分解能構造を発表しました(参考文献1)。
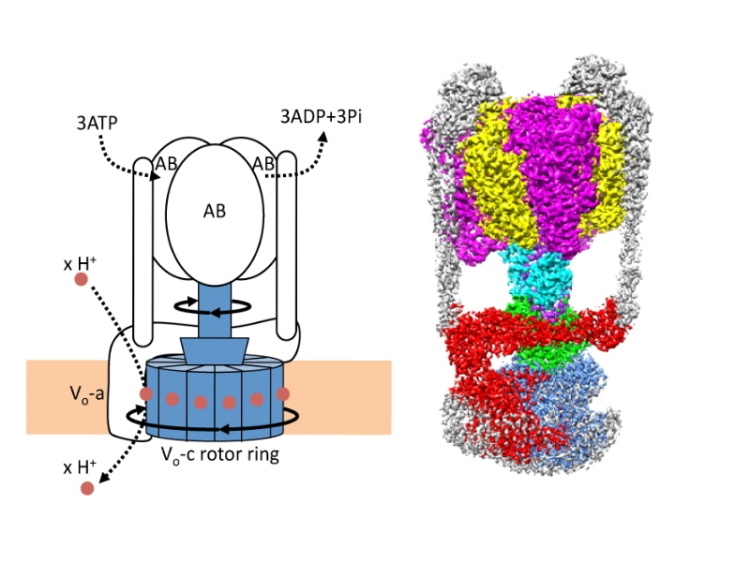
図1 回転分子モータータンパク質の模式図
ATPが V1部分で分解されると中心回転軸が回転し、VO部分でプロトンが輸送される。右:V/A-ATPase 全体のクライオ電顕マップ
ATPが V1部分で分解されると中心回転軸が回転し、VO部分でプロトンが輸送される。右:V/A-ATPase 全体のクライオ電顕マップ
結果と考察
私達は、原核生物のV-ATPase (V/A-ATPase)でも、同じように V1 部分が VO部分から脱離すること、V1部分とVO部分から再び活性を持つ V/A-ATPase が再構成されることを以前明らかにしました(参考文献2)。
今回の研究では、VO部分および V/A-ATPase の全体構造をクライオ電子顕微鏡で明らかにし、2つの構造を比較することで、なぜ脱離したVO部分でプロトンがもれないのかを調べました。
VO部分は、12のプロトン結合部位を有するリング複合体 (dc12) と、プロトンの通り道でリング複合体と相互作用することでプロトン輸送に中心的な役割を担う a サブユニットタンパク質からなります。a サブユニットに対してリング複合体が1回転すると 12 個のプロトンが輸送されます。この a サブユニットには、大きな親水性部位があり、そこがリング複合体の d サブユニットタンパク質と近い位置にあることがわかっていました。a サブユニットが リング複合体に対して回転するには、a サブユニットと d サブユニットが離れている必要があり、実際V/A-ATPase 複合体では、両者は離れた位置関係にあります。今回明らかになった VO の構造では、驚くべきことに a サブユニットの親水性部分と d サブユニットがくっついており、そのためリング複合体が回転できないことで、VOからのプロトンの漏洩がシャットアウトされることが明らかになりました。この a サブユニットの構造変化が、外側にある棒状のEG 複合体が V1部分と結合することで引き起こされることもわかりました。タンパク質の活性が、このような機械的な機構で調節されるのは驚きであり、タンパク質が、生命が作り出した精緻な分子機械であることが、改めて認識されました。
今回の研究では、VO部分および V/A-ATPase の全体構造をクライオ電子顕微鏡で明らかにし、2つの構造を比較することで、なぜ脱離したVO部分でプロトンがもれないのかを調べました。
VO部分は、12のプロトン結合部位を有するリング複合体 (dc12) と、プロトンの通り道でリング複合体と相互作用することでプロトン輸送に中心的な役割を担う a サブユニットタンパク質からなります。a サブユニットに対してリング複合体が1回転すると 12 個のプロトンが輸送されます。この a サブユニットには、大きな親水性部位があり、そこがリング複合体の d サブユニットタンパク質と近い位置にあることがわかっていました。a サブユニットが リング複合体に対して回転するには、a サブユニットと d サブユニットが離れている必要があり、実際V/A-ATPase 複合体では、両者は離れた位置関係にあります。今回明らかになった VO の構造では、驚くべきことに a サブユニットの親水性部分と d サブユニットがくっついており、そのためリング複合体が回転できないことで、VOからのプロトンの漏洩がシャットアウトされることが明らかになりました。この a サブユニットの構造変化が、外側にある棒状のEG 複合体が V1部分と結合することで引き起こされることもわかりました。タンパク質の活性が、このような機械的な機構で調節されるのは驚きであり、タンパク質が、生命が作り出した精緻な分子機械であることが、改めて認識されました。
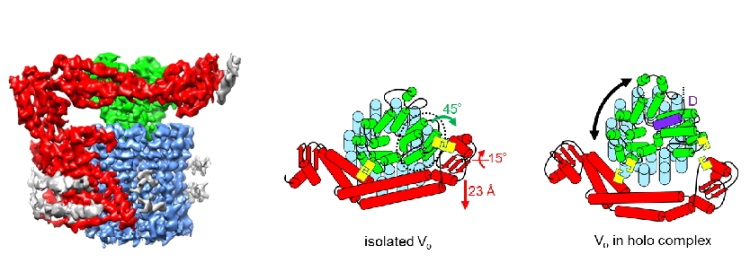
図2. 左:VOのクライオ電顕マップ。赤が a サブユニット、青 リング複合体、緑 d サブユニット。中央:VO単独構造の模式図。赤で表された a サブユニットが d サブユニットにくっついている。右:全体構造中の VOの構造。a サブユニットが d サブユニットと離れており、リング複合体が a サブユニットに対して回転できる。
参考文献
1. Nakanishi A, Kishikawa J, Tamakoshi M, Mitsuoka K, and *Yokoyama K. Nat. Commun. 9, Article number: 89 (2018)
2. Kishikawa J, *Yokoyama K.. J. Biol. Chem. 287, 24597-24603 (2012)
2. Kishikawa J, *Yokoyama K.. J. Biol. Chem. 287, 24597-24603 (2012)
掲載
| DOI | 10.7554/eLife.56862 |
|---|---|
| 『eLife』 | 2020;9:e56862 |
| 共同研究 | 岸川 淳一1 2、中西 温子1 3、古田 綾1、玉腰 雅忠4、加藤 貴之2、難波 啓一5、光岡 薫6、横山 謙1 ※1京都産業大学、2大阪大学蛋白質研究所、3日本学術振興会特別研究員、4東京薬科大学、5大阪大学生命機構研究科、6大阪大学超高圧電顕センター |
謝辞
この研究は、 科研費(基盤研究(B) 17H03648)の支援を受けて実施されました。
