【生命科学部】FoF1-ATPase(ATP合成酵素)のADP阻害型構造をクライオ電子顕微鏡により解明
2025.01.14
概要
京都産業大学 生命科学研究科 卒業生 小林 廉さん(筆頭著者、2024博士前期課程修了)、京都産業大学 生命科学研究科 中野 敦樹さん(博士後期課程3年次生)、横山 謙教授(責任著者)らの研究が、国際的な学術雑誌である Biochimica et Biophysica Acta(BBA)-Bioenergeticsの学術論文として掲載されました。
FoF1 ATP合成酵素は、細胞のミトコンドリアの内膜やバクテリアの形質膜に存在し、呼吸で生じたプロトン駆動力を使って生命のエネルギー通貨であるATPを合成する最も重要な蛋白質の一つです。プロトン駆動力が存在しない場合、ATP合成の逆反応である ATP加水分解反応を触媒することからFoF1-ATP分解酵素(FoF1-ATPase)とも呼ばれます。
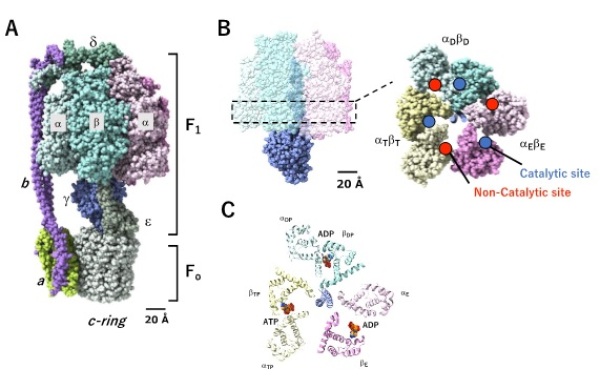
FoF1-ATPaseは ATPを加水分解するF1部分と膜内在性でプロトンチャネルとして働くFo部分から構成されます。F1部分にはATP加水分解を担う3つの触媒部位と、 ATPは結合するが結合したATPが加水分解されないヌクレオチド結合部位である3つの非触媒部位が存在します。
F1の触媒部位にADPが結合したままになると、F1のATP加水分解活性が阻害されますが、この阻害様式はADP阻害と呼ばれています。一方、非触媒部位は ATP加水分解に直接関与しませんが、非触媒部位へのATPの結合を人工的になくすと、F1がADP阻害型に陥り、そのATP加水分解活性が失われることが報告されていました。F1がADP阻害型になる分子機構については長年にわたり解決すべき課題として残されていました。
今回、小林らは、非触媒部位のATP結合能を失ったFoF1(△NC-F0F1)作成し、ADP阻害状態になった△NC-F0F1の構造を、クライオ電子顕微鏡により、2.9Åという高分解能で決定しました。ADP阻害型のFoF1の構造は、野生型の構造とほぼ同じでしたが、触媒部位に結合しているヌクレオチドの種類が異なっていました。最初のATPが結合する触媒部位をEサイトと呼びますが、野生型F1のEサイトにATPが結合しているのに対し、ADP阻害型のFoF1では、ATPのかわりにADPが結合していました。また、ATP分解の場であるDサイトに関しては、野生型F1ではADPとリン酸が結合しているのに対して、ADP阻害型のFoF1では、リン酸はなくADPだけ結合していました。このことから、ADP阻害型のFoF1では、Eサイトに結合しているADPによりATPの新たな結合が妨げられ、Dサイトのリン酸が失われることで、ADP阻害構造が安定化されることがわかりました(図1)。
FoF1 ATP合成酵素は、細胞のミトコンドリアの内膜やバクテリアの形質膜に存在し、呼吸で生じたプロトン駆動力を使って生命のエネルギー通貨であるATPを合成する最も重要な蛋白質の一つです。プロトン駆動力が存在しない場合、ATP合成の逆反応である ATP加水分解反応を触媒することからFoF1-ATP分解酵素(FoF1-ATPase)とも呼ばれます。
FoF1-ATPaseは ATPを加水分解するF1部分と膜内在性でプロトンチャネルとして働くFo部分から構成されます。F1部分にはATP加水分解を担う3つの触媒部位と、 ATPは結合するが結合したATPが加水分解されないヌクレオチド結合部位である3つの非触媒部位が存在します。
F1の触媒部位にADPが結合したままになると、F1のATP加水分解活性が阻害されますが、この阻害様式はADP阻害と呼ばれています。一方、非触媒部位は ATP加水分解に直接関与しませんが、非触媒部位へのATPの結合を人工的になくすと、F1がADP阻害型に陥り、そのATP加水分解活性が失われることが報告されていました。F1がADP阻害型になる分子機構については長年にわたり解決すべき課題として残されていました。
今回、小林らは、非触媒部位のATP結合能を失ったFoF1(△NC-F0F1)作成し、ADP阻害状態になった△NC-F0F1の構造を、クライオ電子顕微鏡により、2.9Åという高分解能で決定しました。ADP阻害型のFoF1の構造は、野生型の構造とほぼ同じでしたが、触媒部位に結合しているヌクレオチドの種類が異なっていました。最初のATPが結合する触媒部位をEサイトと呼びますが、野生型F1のEサイトにATPが結合しているのに対し、ADP阻害型のFoF1では、ATPのかわりにADPが結合していました。また、ATP分解の場であるDサイトに関しては、野生型F1ではADPとリン酸が結合しているのに対して、ADP阻害型のFoF1では、リン酸はなくADPだけ結合していました。このことから、ADP阻害型のFoF1では、Eサイトに結合しているADPによりATPの新たな結合が妨げられ、Dサイトのリン酸が失われることで、ADP阻害構造が安定化されることがわかりました(図1)。
波及効果・今後の予定
今回の研究により、長年の謎であったADP阻害型FoF1の構造が明らかになりました。従来予想されていたような 特別なADP阻害構造ではなく、触媒部位に結合しているヌクレオチドの種類の違いによりF1部分のATP分解活性が失われることがわかりました。しかし、非触媒部位のATP結合活性をなくすことで このようなヌクレオチド結合状態になる仕組みは、依然解決すべき課題として残されています。F1-ATPaseは、ナノ単位で動作する回転分子モーターであり、その分子機構の解明は将来のナノマシーンの設計を可能にする重要な情報を提供します。F1によるATPの加水分解機構を完全に理解するためにも、ADP阻害構造の解明は大きな一歩になったと考えています。
この論文は2025年1月8日にBBA-bioenergeticsにオンライン掲載されました。
doi:https://doi.org/10.1016/j.bbabio.2025.149536
この論文は2025年1月8日にBBA-bioenergeticsにオンライン掲載されました。
doi:https://doi.org/10.1016/j.bbabio.2025.149536
