【生命科学部】ヒト由来パネキシン3チャネル蛋白質の高分解能構造をクライオ電子顕微鏡により解明
2024.12.23
概要
京都産業大学 生命科学研究科 寺村 龍河さん(修士課程1年生)、京都産業大学 生命科学部 津山 泰一研究員、横山 謙教授らの研究が、国際的な学術雑誌である Biochemical and Biophysical Research Communications(BBRC)の学術論文として掲載されました。
細胞膜に存在する膜タンパク質を介したATPなどの生体分子の輸送は、重要なシグナル伝達メカニズムです。このような比較的大きな膜タンパク質は、ラージポアチャネルとして分類されており、イオンや代謝物を比較的低い選択性で透過させることができます。大孔径チャネルの主要なクラスはパネキシンファミリーであり、脊椎動物種間で保存されている3つのメンバー(PANX1、PANX2、PANX3)から構成されています。
PANX1/2の構造はすでに報告されており、PANX3に関しては、今年になってATPとカルシウムイオン存在下での構造が報告されましたが、その分解能は低く、なにも結合していないアポ型の構造は未解明でした。
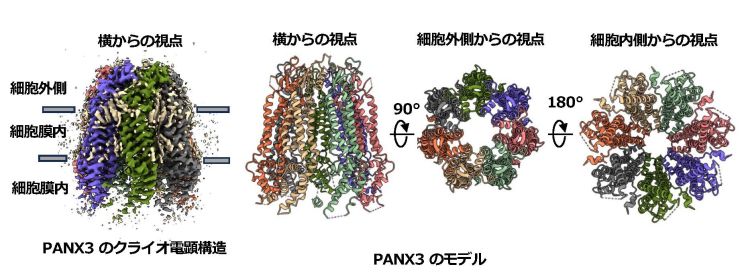
今回、津山、寺村らは、アポ型のPANX3の構造をクライオ電子顕微鏡により2.9Åという高分解能で解明しました(図1)。決定されたPANX3チャネルは7量体で、中心対称軸に沿って膜貫通孔を形成しています。孔の最も狭い狭窄部は細胞外領域に位置するイソロイシン環で構成され、その大きさは他のパネキシンと同程度でした。構造変異解析 (Structural Variability analysis)の結果、細胞内領域における顕著な構造ダイナミクスが明らかになり、パネキシンチャネルの詳細な特性を理解するための構造基盤を解明することができました。
細胞膜に存在する膜タンパク質を介したATPなどの生体分子の輸送は、重要なシグナル伝達メカニズムです。このような比較的大きな膜タンパク質は、ラージポアチャネルとして分類されており、イオンや代謝物を比較的低い選択性で透過させることができます。大孔径チャネルの主要なクラスはパネキシンファミリーであり、脊椎動物種間で保存されている3つのメンバー(PANX1、PANX2、PANX3)から構成されています。
PANX1/2の構造はすでに報告されており、PANX3に関しては、今年になってATPとカルシウムイオン存在下での構造が報告されましたが、その分解能は低く、なにも結合していないアポ型の構造は未解明でした。
今回、津山、寺村らは、アポ型のPANX3の構造をクライオ電子顕微鏡により2.9Åという高分解能で解明しました(図1)。決定されたPANX3チャネルは7量体で、中心対称軸に沿って膜貫通孔を形成しています。孔の最も狭い狭窄部は細胞外領域に位置するイソロイシン環で構成され、その大きさは他のパネキシンと同程度でした。構造変異解析 (Structural Variability analysis)の結果、細胞内領域における顕著な構造ダイナミクスが明らかになり、パネキシンチャネルの詳細な特性を理解するための構造基盤を解明することができました。
波及効果・今後の予定
ラージポアチャネルは、ATPなどの透過を通して様々なシグナルを媒介します。PANX3は、筋肉や皮膚、骨などで発現し、細胞分化や傷による炎症反応に関与することが知られています。今回の研究で明らかになった PANX3の高分解構造は、未だに解明されてないラージポアチャネルによる透過機構の理解の一助になるともに、ラージポアチャネルが関係した疾病の原因解明にも繋がります。今後は、PANX1やPANX3の変異体の構造解析により、ポアの開閉機構の解明に資する構造機能解析を進めていきます。
この論文は2024年12月21日(土曜日)にBBRCにオンライン掲載されました。
doi: https://doi.org/10.1016/j.bbrc.2024.151227
この論文は2024年12月21日(土曜日)にBBRCにオンライン掲載されました。
doi: https://doi.org/10.1016/j.bbrc.2024.151227
