【生命科学部】小胞体レドックスタンパク質ERp18の亜鉛イオン依存的な機能制御機構を解明し、 その機構が酸化ストレスや老化の抑制に寄与することを解明
2024.02.13
京都産業大学 生命科学部の永田 和宏名誉教授、潮田 亮准教授、生命科学研究科大学院生の堤智香らの研究グループは、Zn2+を介したERp18の新たな機能制御メカニズムを解明しました。この制御機構の発見は、細胞内のZn2+動態と、老化や酸化ストレスを原因とする疾患を結びつける重要な発見であり、疾患発生メカニズムの理解から、新たな治療法開発の足掛かりになることが期待されます。
研究のポイント
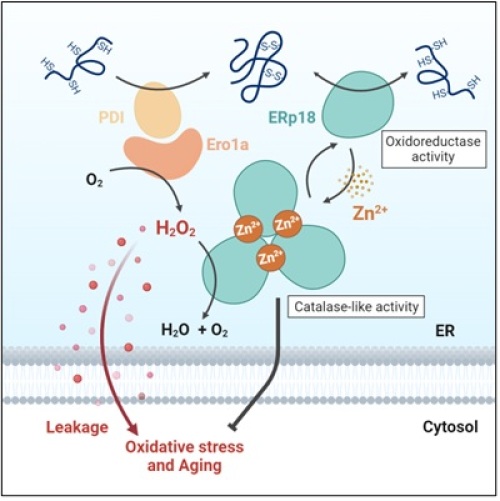
- ERp18は活性中心を介して亜鉛イオン(Zn2+)と結合し、三量体を形成する。
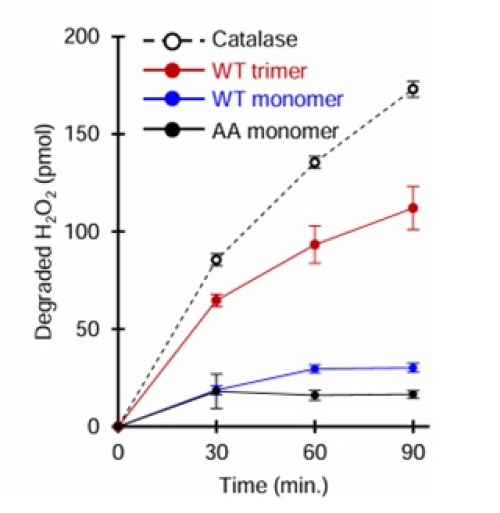
- Zn2+と結合していないERp18は酸化還元酵素として機能するが、Zn2+ 結合した三量体ERp18はカタラーゼ様の過酸化水素除去活性を獲得する。
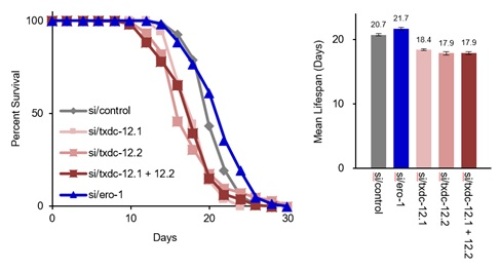
- ERp18の過酸化水素除去活性は、酸化ストレス*1や細胞老化の進行を抑制する。また、ERp18は線虫の個体老化にも影響を与え、ERp18の発現抑制は線虫の寿命を短縮させた。
概要
京都産業大学 生命科学部の永田 和宏名誉教授、潮田 亮准教授、生命科学研究科大学院生の堤 智香らの研究グループは、Zn2+を介したERp18の新たな機能制御メカニズムを解明しました。この制御機構の発見は、細胞内のZn2+動態と、老化や酸化ストレスを原因とする疾患を結びつける重要な発見であり、疾患発生メカニズムの理解から、新たな治療法開発の足掛かりになることが期待されます。
本研究の成果は米国学術雑誌「Cell Reports」にアクセプトされました。
本研究の成果は米国学術雑誌「Cell Reports」にアクセプトされました。
背景
細胞小器官の1つである小胞体は、タンパク質フォールディングの場として知られ、細胞内で合成される1/3ものタンパク質が小胞体成熟します。小胞体にはタンパク質のフォールディングを促すため、多くの分子シャペロンや酸化還元酵素が存在し、フォールディングを介助します。また、小胞体で合成されるタンパク質の多くは、翻訳後に糖鎖付加やリン酸化などの翻訳後修飾*2を受け成熟します。その中でも、ジスルフィド結合形成はタンパク質の構造を保つうえで重要な翻訳後修飾です。ジスルフィド結合の形成は小胞体内の酸化酵素によって触媒されますが、その反応過程で活性酸素種*3のひとつである過酸化水素を発生させます。産生された過酸化水素は、酸化反応に有利な環境を作る環境要因の1つですが、過剰な過酸化水素の産生は酸化ストレスを惹起させ、細胞老化の原因になることが知られています。したがって、細胞内の過酸化水素濃度がどのように適切に維持されているかを理解することは重要な課題であると言えます。サイトゾル*4の場合、主要な還元酵素チオレドキシンが抗酸化反応の中心を担い、酸化ストレスから細胞を防御しています。今回、我々が注目したERp18はサイトゾルのチオレドキシンと類似した構造を持つことが知られておりましたが、これまで小胞体でどのような役割があるのか不明でした。本研究では、精製ERp18による試験管内の実験から、モデル生物である線虫*5を用いた個体レベルの実験まで行い、ERp18の機能解明を目指し、研究を進めました。
研究成果
哺乳類から線虫まで、ERp18の遺伝子を持つ生物においてアミノ酸配列の保存性を調査したところ、ERp18は酸化還元反応の活性中心CXXCモチーフ*6の付近にヒスチジン残基(H)が存在することが分かりました。このヒスチジン残基とCXXCモチーフを含むHXXXCXXCモチーフは、Zn2+と相互作用する可能性があることが示唆され、ERp18がHXXXCXXCモチーフを介してZn2+と結合し、Zn2+との結合がERp18三量体形成の引き金であることを見出しました。このZn2+結合型の三量体ERp18は、ERp18が本来持っていた酸化還元活性を失っており、その代わりに過酸化水素の除去活性を獲得しました。2つの異なる酵素活性をZn2+依存的な多量体化によって切り替えるという発見は、これまでに例のないユニークな機能制御機構でした。さらに、ERp18の欠失した細胞では、分解できなかった過酸化水素が小胞体からサイトゾルへ漏出し、酸化ストレスや細胞老化の亢進を引き起こすことがわかりました。ERp18による酸化ストレスや老化対する影響は、線虫においても同様の影響が認められ、線虫でのERp18ノックダウンは寿命の短縮を引き起こしました。本研究による新たな過酸化水素分解機構の発見は、老化の分子メカニズムや酸化ストレスに関連する疾患の発症機構を解明するための重要な知見であると言えます。
今後の展開
今回、機能未知因子であったERp18のZn2+による機能の切り替えと、その活性が酸化ストレスや寿命に影響を及ぼすことを見出しました。酸化ストレスは老化を早めるだけではなく、神経変性疾患、腎機能障害、心疾患の原因のひとつであると考えられています。Zn2+を介したERp18による抗酸化反応の活性化は、これらの疾患に対する新たな治療戦略に繋がると考えています。また、Zn2+は私たち人間が健康に生きていくための微量必須元素として、毎日の摂取が推奨されています。Zn2+の不足もまた、味覚障害をはじめ皮膚炎や脱毛症などの症状を引き起こす原因であるとされています。これらの症状には原因不明のものも多く、ERp18の関与を追及することで、発症メカニズムの解明に貢献できると期待しています。
用語・事項の解説
*1. 酸化ストレス
細胞内には、活性酸素種による損傷を防ぐいくつかの抗酸化システムが備わっており、酸化ストレスを防いでいる。酸化ストレスとは活性酸素種による損傷作用と、抗酸化システムとの均衡が破綻し、生体分子の損傷が上回った時に発生するストレスのこと。
*2. 翻訳後修飾
タンパク質合成装置リボソームの翻訳によって合成されたタンパク質が受ける化学的修飾である。タンパク質の立体構造や機能発現、活性の強さに影響を与える。
*3. 活性酸素種
反応性の高い酸素原子を含む分子で、ROS (reactive oxygen species)としても知られる。その高い反応性により、DNAタンパク質、脂質に損傷を与え、発癌や老化を促進する一因である。
*4. サイトゾル
細胞の中の核、ミトコンドリア、小胞体などの細胞小器官を除いたそれ以外の部分。
*5. 線虫
体長~1 mmで飼育しやすく、ライフサイクルが短い、体が透明である、全ゲノム配列が解読済みである、などの理由から、モデル生物として研究材料としてよく用いられている。その特性から、寿命や神経伝達、蛍光タンパク質を用いた観察に適したモデル生物である。
*6. CXXCモチーフ
酸化還元反応の活性中心となる部分。CXXCモチーフの、Cはシステイン残基を指し、Xの位置にはタンパク質によって異なるアミノ酸残基が当てはまる。
参考図
論文情報
| 論文タイトル | 「Zn2+-dependent functional switching of ERp18, an ER-resident thioredoxin-like protein」 (小胞体チオレドキシン様タンパク質ERp18のZn2+依存的な機能制御) |
|---|---|
| 掲載誌 | 米国科学雑誌(Cell Reports)(オンライン版) |
| 掲載日 | 2024年2月7日(水)午前11時(米国東部時間) |
| 著者 | 堤 智香1、上垣 日育、山下 龍志、潮田 亮2、永田 和宏2(京都産業大学生命科学部、京都産業大学タンパク質動態研究所) (1筆頭著者、2責任著者)(研究当時) |
| DOI | 10.1016/j.celrep.2024.113682 |
謝辞
本研究は、科学技術振興機構における戦略的創造研究推進事業JST-CREST「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域 研究課題名「小胞体恒常性維持機構:Redox, Ca2+, タンパク質品質管理のクロストーク」(課題番号:JPMJCR13M6 研究代表者:永田 和宏)、科学研究費補助事業における学術変革領域研究(A)「新興硫黄生物学が拓く生命原理変革」研究領域 研究課題名「タンパク質品質管理を支える電子移動媒体としての超硫黄分子の役割」(課題番号:21H05268 研究代表者:潮田 亮)、科研費「基盤研究(S)(課題番号:JP18H04002 研究代表者:永田 和宏)」、科研費「基盤研究(B)(課題番号:JP22H02622 研究代表者:潮田 亮)」、科研費「基盤研究(C)(課題番号:JP18K06140 研究代表者:潮田 亮)」、日本医療研究開発機構(AMED)における革新的先端研究開発支援事業AMED-CREST「プロテオスタシスの理解と革新的医療の創出」研究領域 研究課題名「プロテオスタシスにおけるタンパク質構造形成機構の包括的解明」(課題番号:JP21GM1410008 研究代表者:田口 英樹 研究分担者:潮田 亮)および武田科学振興財団の支援により実施されました。
