【生命科学部】クライオ電子顕微鏡により捉えたATP合成酵素の回転機構
2023.07.18
-ATP合成酵素FoF1は小刻みなステップで回転する。-
概要
私たち生命は、ATPが持つエネルギーを利用することで生命活動を維持しています。ATPの大部分は、ATP合成酵素であるFoF1により作られます。またFoF1は、ATPを加水分解することで分子中心にあるγサブユニットを回転させるATP駆動性の分子モーター蛋白質でもあります。バクテリア型FoF1を材料とした研究により、FoF1は1回転中に6ヵ所で停止しながら回転することがわかっていました。しかし、さらに細かい停止があるのか、その時どのような化学反応が FoF1上で起こっているかは、明らかにされていませんでした。
生命科学研究科の中野 敦樹さん(博士課程2年次生、横山研究室所属)は、クライオ電子顕微鏡による構造解析により、γサブユニットの回転角度が異なる18種類の構造が存在することを示し、FoF1が従来考えられてきたよりも細かいステップを刻みながら回転することを明らかにしました。ATPの加水分解反応と関わっていないステップがあることから、分子内のねじれも回転に寄与することが示されました。本研究は、2023年7月11日に英国科学雑誌 Nature Communications(Nature Publishing Group 発刊) に掲載されました。
背景
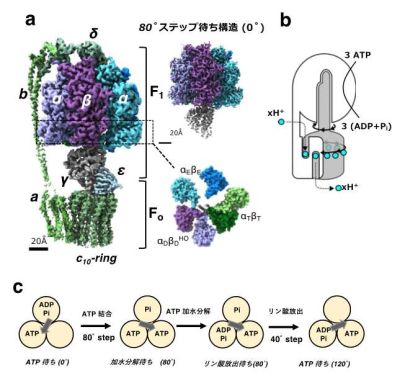
私たちを含む全ての生命は、ATP(アデノシン三リン酸)と呼ばれるエネルギー貯蔵物質を分解したときに得られるエネルギーを用いて生命活動を維持しています。ATP合成酵素FoF1は、ミトコンドリア内膜に存在し、生命維持に使われる大部分のATPを合成しています。FoF1は、生体膜を横断する水素イオンの流れを利用することで、タービンのようなリング状の構造を回転させます。この時、F1部分のγサブユニットも一緒に回転し、その回転力でATPを合成します。まるで水力発電のような仕組みでATPを合成しているわけです。逆に、FoF1はATPを分解することで逆向きに回転し、水素イオンを輸送することもできます。ATP加水分解による回転機構が明らかになれば、合成方向の回転機構を解明することにもつながることになります。そのため、ATP駆動性回転機構について長年にわたり多くの研究者がその解明に取り組んできました。
結果
中野 敦樹さん(博士2年次)、横山 謙教授(京都産業大学)、岸川 淳一准教授(現京都工芸繊維大学)、光岡 薫教授(大阪大学)らのグループは、クライオ電子顕微鏡を用いた構造解析により、ATP合成酵素FoF1の回転中の中間体構造を多数捉えること成功しました。クライオ電子顕微鏡による単粒子解析は、反応中で複数の構造が混在したサンプルであってもクラス分けによって同時に構造決定することが可能です。低いATP濃度でFoF1を反応させることで、ATP結合前構造を、高いATP濃度で反応させることで、ATPの加水分解、分解物のADPとPi-の放出に対応する構造の分離を試みました。
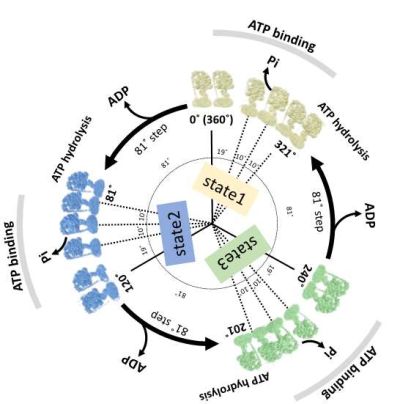
筆頭著者の中野 敦樹さんは、クラス分けを工夫することで、従来明らかにされていなかったγサブユニットのより細かい回転角度を示すF1部分の構造を複数分離することに成功しました。その結果、360°回転中の18種類の構造を得ることができました(図2)。ATPの加水分解サイクルに対応した構造だけでなく、反応過程とは対応しない複数の構造も明らかになりました。
今回の研究で得られた構造から以下のことがわかりました。ATP濃度が高い条件では、すべての構造においてE siteにATPが結合しており、このことは、ATPの濃度が高い条件では、どの回転角度に対応したF1部分のE siteに対してもATPが結合できることを示します(図2)。また高ATP濃度条件では、すべての触媒サイトにATPもしくはADPが結合していることから、新たにATPが結合することができず、そのため結合したATPにより80˚回転が起こることがわかりました。
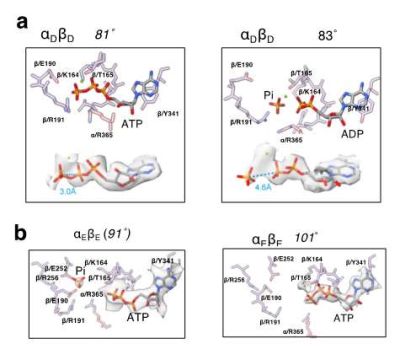
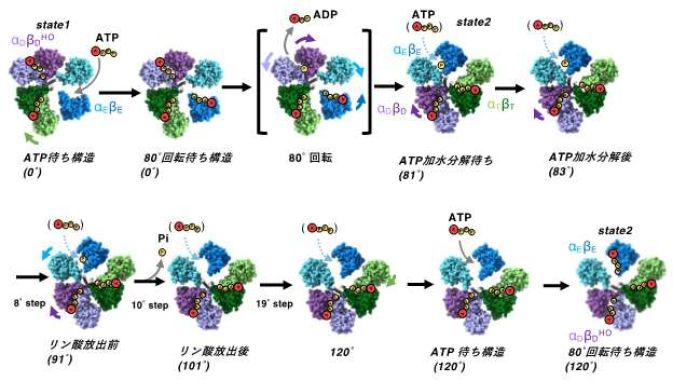
80˚回転待ち構造 (これを0˚構造と呼びます)に対して、γサブユニットの回転角度が 81˚の構造が得られましたが、D site にはATPが結合しており、一方γの回転角度が 83˚の構造のD site では、ADP と Piが結合していました(図3a)。このことから、81˚→83˚の構造変化の過程で D siteのATPが加水分解されることがわかりました。γサブユニットの回転角度が 91˚の構造では、E site に Piと ATPが結合していましたが、γサブユニットの回転角度が 101˚の構造の E siteにはPiが結合していませんでした(図3b)。このことは 91˚→101˚の過程でPiが放出されることを示します。さらにγサブユニットが 19˚動いた 120˚構造が分離されましたが、ATPの触媒過程とは関係なくγサブユニットが動いています。このことは、この 19˚の動きが分子内に蓄積された捻じれによって駆動された可能性を示します。ATPの結合により引き起こされた 80˚回転後に蓄積された捻じれではないかと考えていますが、分子動力学計算などによるさらなる検証が必要です。
今後の展開
用語・事項の解説
- FoF1-ATP合成酵素: 真核生物では、ミトコンドリアの内膜に存在し、呼吸で生じたプロトン駆動力を使って ATPを合成する。葉緑体のチラコイド膜にも存在し、炭酸同化に必要なATPを生産する。多くの細菌の形質膜にも存在するが、今回の実験では、好熱性細菌のFoF1を材料にした。
- 1分子回転観察実験:F1のγサブユニットに光学顕微鏡で観察できる大きさのビーズを結合させ、ATPでγサブユニットが回転する様子を直接観測する手法。この方法により、回転することでATPが合成されることを実験的に裏付けた。
- クライオ電子顕微鏡:凍結した試料を観察する電子顕微鏡のこと。凍結したタンパク質試料を電子により見ることができる。場合によってはタンパク質をつくる原子一つ一つを直接見ることも可能。
