ミトコンドリアにバレル(円筒)型膜タンパク質をつくる仕組みを解明
2023.01.17
本件のポイント
- 私たちは2年前に、ミトコンドリア外膜上でSAM複合体(膜タンパク質複合体)がバレル(円筒)型構造の膜タンパク質を膜に組込む仕組みを、クライオ電子顕微鏡構造に基づいて明らかにしました。今回は、バレル型構造を作る途中の基質タンパク質のスナップショット構造をクライオ電子顕微鏡解析で決定することに成功し、どのようにシート状の構造が円筒系に巻き上がって円筒型構造となるのか、そのユニークな仕組みを明らかにしました。
- ミトコンドリア外膜には小分子やタンパク質が通る孔を提供する「βバレル型膜タンパク質」が存在し、ミトコンドリアの機能に必須です。しかし、どのようにしてバレル(円筒)型の構造ができるのかは、不明でした。この問題を解決するために、バレル構造形成が遅くなるような基質変異体タンパク質を作製、 SAM複合体上のバレル構造形成途中の変異体の精密構造をクライオ電子顕微鏡で決定しました。その結果、基質タンパク質がシート状に折れたたまれ、それが複数の部位で内側に巻き上がるように導かれて、最終的に円筒形ができあがる、というユニークなメカニズムが明らかになりました。
- ミトコンドリア機能に必須のβバレル型膜タンパク質の構造形成のメカニズムの解明により、ミトコンドリアのβバレル型膜タンパク質に関連する病気の治療法の開発や、ミトコンドリア膜へのタンパク質組込みの効率を制御することで老化を防ぐなどの新たな可能性が開けることが期待されます。
概要
背景
ヒトや酵母などの真核生物の細胞内には、ミトコンドリアをはじめとする膜で仕切られた細胞内小器官(オルガネラ)が存在します。ミトコンドリアは細胞内で生命活動に必要なエネルギーを産生します。そのため、ヒトではミトコンドリアが正常に機能することが健康につながり、ミトコンドリアの機能低下は老化や神経変性疾患をはじめとするさまざまな病態と関連することが知られています。ミトコンドリアは外膜と内膜の二枚の生体膜に囲まれ、1000種類以上のタンパク質から構成されており、これらのタンパク質のほとんどは、ミトコンドリアの外で合成されてからミトコンドリア内へと搬入されますが、この搬入のためにはタンパク質が通る孔(Tom40)が必要です。さらにミトコンドリアが正常に機能するためには、ミトコンドリア内で産生されたエネルギーの通貨であるATPや様々な代謝物質をミトコンドリアの中から外に送り出したり取り込んだりする孔(porin/VDAC)も必要です。これらの孔は外膜でβバレル型膜タンパク質と呼ばれる円筒形(バレル型)の膜タンパク質がつくっています。
アミノ酸がつながったヒモであるタンパク質はどのようにバレル型の形になるのでしょうか。バレル型構造をつくるためには、タンパク質のヒモを端からジグザグに折りたたんでβシートというシート(平面)状の構造をつくり(ジグザグ型の1本1本をβストランドと呼びます)、これを巻き上げてバレル型にする必要があります。βシートは完全な平面ではなく、どちらかといえば凹面を作る性質がありますが、円筒形にするためには凹面の曲率をさらに大きくする、すなわちシートを巻き上げる必要があります。βバレル型膜タンパク質の外膜への組込みを担うSAM複合体上で、どのようにしてこの「巻き上げ」が起こるのかはこれまで分かっていませんでした。本研究グループは、2001年に2種類のサブユニット組成から成るSAM複合体の精密構造をクライオ電子顕微鏡を用いた単粒子解析法(注4)で決定し、その構造から、 SAM複合体は構成サブユニットと基質を順番に入れ替えることで、基質のバレル型タンパク質を外膜に組込むことを見出しました(図1)。そして残された最大の問題が、「基質のβシートがいかに円筒形に巻き上げられるか?」でした。
研究成果
クライオ電子顕微鏡によるSAM複合体上のバレル構造形成途上の基質の精密構造決定
本研究グループは、SAM複合体上で基質タンパク質が円筒形に巻き上げられる仕組みを解明するために、基質としてβバレル型膜タンパク質のTom40を選び、そのバレル構造形成が遅れる変異体を作製しました。そして酵母細胞からSAM複合体とこのTom40変異体の複合体を精製し、東京大学のクライオ電子顕微鏡を用いて、精密構造を3.2Åの分解能で決定しました(図2)。
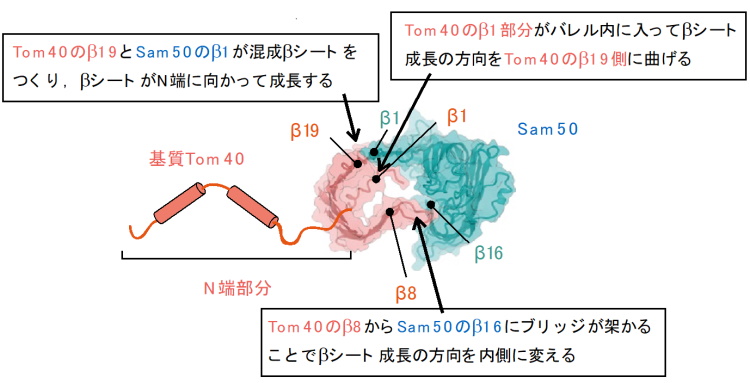
SAM複合体は、2つのSam50(これもβバレル型膜タンパク質)、1つずつのSam37とSam35から構成されていますが、今回決定した構造では、SAM複合体上で2つのSam50の内1つが基質のTom40(の変異体)に置き換わっていました。最終的にはTom40は19本のβストランドから成るバレル(円筒)型構造をつくりますが、今回の構造形成途中のTom40ではC端側の19番目のβストランド(β19)から8番目のβストランド(β8)までのβシートが見えていました。β19はSam50の最初のβストランド(β1)と(混成)βシートをつくって、そこを拠点としてβ19がβ18とβシートをつくり、β18はβ17とβシートをつくり・・という形で、C端からN端に向かってβ8までβシートが作られていました(図3)。すなわち、基質Tom40の途中までβシートが巻き上がったところのスナップショット構造が得られました。
どのようにして基質Tom40のβシートは円筒形に巻き上がっていくのでしょうか。今回の構造では、β8付近でβシートが大きく内側に屈曲していました。これを可能にしたのは、β9とβ8をつなぐループがSam50の方に大きく伸びて、Sam50に一時的に結合していたことにあります(図3)。このループがSam50と円筒形成途上のTom40の間にブリッジ(橋)を架ける役割をして、βシートの成長方向を大きく方向転換していました。この橋の下には大きな空間があり、そこには電顕密度が見えていましたが、これはβストランドを形成途中のβ7とβ6の密度と考えられました。そこからN端側についてはβストランドは見えませんでしたが、意外にもTom40のN端部分付近に対応する密度ができかけのβバレルの中のβ19付近に見えていました。これは分子ダイナミクス計算から、最終的には1番目のβストランド(β1)を作るべき部分が、βストランドではなくヘリックス構造をつくって、β19の近くで、できかけのβバレルの内壁と相互作用していることがわかりました(図3)。最終的にはβ1がβ19とシートをつくってβバレルが閉じることを考えると、β1に成るべき部分がβ19のすぐ近くに来ることで、上述のループとともに、βシートが巻き上がる方向を大きく内側に変える役割をしていると考えられました。この後、βバレルはβ5からβ2までβシートが形成されていき、最後はβ1に先立つN端部分がバレル内のβ1部分をバレルの内壁から追い出される。追い出されたβ1部分がSam50のβ1と入れ替わってTom40のβ19とβシートをつくることで、βシートが円筒形に閉じてβバレルが完成すると考えられます。
以上は、基質のTom40の変異体の構造解析に基づいて考えられた構造形成のモデルですが、変異体ではなく野生型のTom40を用いた細胞内での架橋実験から、野生型Tom40でも同様の構造形成機構でバレル構造が作られることが分かりました。
今後の展望
用語・事項の解説
1.ミトコンドリア
酵母からヒトまで広く真核生物の細胞内に見られる必須の細胞内小器官。生命活動に必要なエネルギー(ATP)を酸素呼吸によって産生するほか、さまざまな物質の代謝やアポトーシス(細胞死)にも関わる。ミトコンドリアの機能低下や機能異常と、老化やがん、糖尿病、さまざまなミトコンドリア病との関連が分かっている。ミトコンドリアの機能を健全に保つことがヒトの健康に重要であることから、異常ミトコンドリアを除去する方法や健全なミトコンドリアを増やす方法の開発が注目されている。
2. β-バレル型膜タンパク質
タンパク質のポリペプチド鎖が折り返して順次逆平行に並んでいくことで作られるβシートという二次構造をつくることができる。このβシートが円筒形(バレル型)に丸まって作られるタンパク質をβバレルタンパク質という。このときバレル型構造の外側が疎水性、内側が親水性になることで、生体膜に埋め込まれるタイプの膜タンパク質をβバレル型膜タンパク質という。ほとんどの膜タンパク質はらせん状の二次構造である疎水性αヘリックスから組み立てられているので、βバレル型膜タンパク質は例外的な膜タンパク質ということになる。細菌の外膜には様々なβバレル型膜タンパク質が存在し、細胞外からの物質の取り込みなどの役割を担っている。真核生物では細菌に起源をもつミトコンドリアと葉緑体の外膜にβバレル型膜タンパク質が存在し、やはりミトコンドリアや葉緑体の内外の物質の出入りを担っている。
3. SAM複合体
ミトコンドリアの外膜にβ-バレル型膜タンパク質を組み込む装置として働く膜タンパク質複合体。酵母ではβ-バレル膜タンパク質のSam50とSam35、 Sam37から構成されるが、ヒトなど哺乳動物のミトコンドリアではSam50とメタキシンから構成される。細菌の外膜でβ-バレル型膜タンパク質を組み込む装置はBAM複合体であり、その中心サブユニットのBamA(β-バレル型膜タンパク質)とSam50は進化的に類似しているが、他のサブユニットは異なる。
4. クライオ電子顕微鏡による単粒子解析法
生体試料を液体窒素(-196℃)冷却下で急速凍結して電子線を照射し、生体分子を染色することなく電子顕微鏡で観察する(クライオ電子顕微鏡法)。これまでの精密構造決定の主役であったX線構造解析には試料の結晶化が必須だったが、良質のデータの高感度取得法および大量の画像データから三次元構造を再構成する手法(単粒子解析法)の開発により、結晶化しない生体試料でも解像度3Å程度の構造を決定することができるようになった。この方法の進展により、これまで結晶化が困難であったタンパク質の巨大複合体や膜タンパク質の構造解析が急速に進むようになった。2017年に、その開発に貢献した研究者3名がノーベル化学賞を受賞している。
論文情報
| タイトル | 「A multipoint guidance mechanism for β-barrel folding on the SAM complex」 (βバレル構造はSAM複合体上で多点ガイド機構で作られる) |
|---|---|
| 掲載誌 | 英国科学誌『Nature Structural and Molecular Biology』 |
| 掲載日 | 2023年1月6日(火)(日本時間) |
| 著者 | 竹田弘法1、遠藤斗志也2(京都産業大学) 包明久、吉川雅英、(東京大学) 山守 優、本野千恵、富井健太郎、今井賢一郎(産業技術総合研究所) 広川貴次(筑波大学) Thomas Becker (ドイツ・ボン大学) Caroline Lindau、 Iniyan Ganesan、 Lena-Sophie Wenz、 Nils Wiedemann、Nikolaus Pfanner(ドイツ・フライブルグ大学) (1筆頭著者、2責任著者)(研究当時) |
| DOI | 10.1038/s41594-022-00897-2 |
添付資料
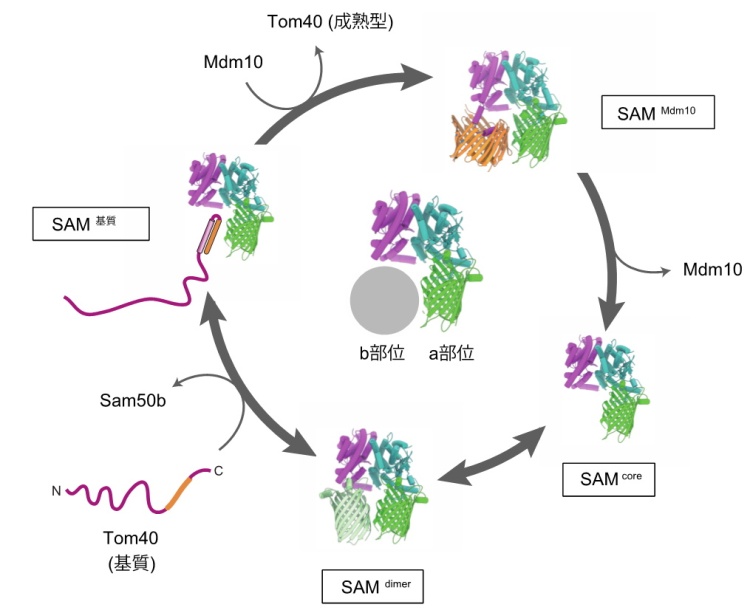
SAMdimer複合体のb部位のSam50と基質のβバレル型膜タンパク(Tom40など)とが入れ替わる。基質はバレル型構造を形成しながら外膜に組み込まれる。SAM複合体のもう一つのサブユニットMdm10(βバレル型膜タンパク)が成熟体Tom40と入れ替わり、バレル型構造を作ったTom40をSAM複合体から追い出す。Mdm10とSam50が再び入れ替わって最初の状態に戻る。
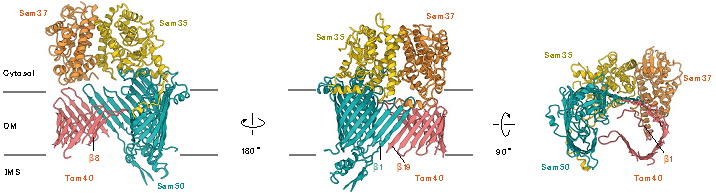
赤が基質Tom40。途中までβバレル構造ができていることがわかる。