ミトコンドリアにバレル(円筒)型膜タンパク質を組み込む仕組みを解明 -- 英国科学誌Nature(オンライン版)に掲載
2021.01.08
京都産業大学生命科学部 遠藤 斗志也 教授らの研究グループは、ミトコンドリア外膜の(膜タンパク質複合体)SAM複合体について、構成サブユニット(タンパク質)が異なる二つの複合体の高分解能立体構造をクライオ電子顕微鏡解析で決定しました。SAM複合体が構成タンパク質を入れ替えながら、基質となる膜タンパク質に円筒形(バレル型)の形を作らせつつ外膜に組み込む、新規の仕組みを明らかにしました。ミトコンドリア外膜の機能に必須のβ-バレル型膜タンパク質組み込みのメカニズムの解明により、ミトコンドリアの膜タンパク質組み込みやβ-バレル型膜タンパク質に関連する病気の治療法の開発や、ミトコンドリア膜へのタンパク質組み込みの効率を制御することで老化を防ぐなどの可能性が開けることが期待されます。
本件のポイント
- ミトコンドリア外膜の(膜タンパク質複合体)SAM複合体について、構成サブユニット(タンパク質)が異なる二つの複合体の高分解能立体構造をクライオ電子顕微鏡解析で決定しました。SAM複合体が構成タンパク質を入れ替えながら、基質となる膜タンパク質に円筒形(バレル型)の形を作らせつつ外膜に組み込む、新規の仕組みを明らかにしました。
- ミトコンドリア外膜には小分子やタンパク質の通り道を提供するバレル型構造の膜タンパク質(β-バレル型膜タンパク質)が存在し、ミトコンドリアの機能に必須ですが、それらの膜タンパク質がどのようにバレル型をつくって膜に組み込まれるのかはこれまで不明でした。細菌の外膜にも進化的に近い組み込み装置がありますが、それとは組み込みの仕組みがかなり異なることもわかりました。
- ミトコンドリア外膜の機能に必須のβ-バレル型膜タンパク質組み込みのメカニズムの解明により、ミトコンドリアの膜タンパク質組み込みやβ-バレル型膜タンパク質に関連する病気の治療法の開発や、ミトコンドリア膜へのタンパク質組み込みの効率を制御することで老化を防ぐなどの可能性が開けることが期待されます。
概要
ミトコンドリア(注1)は細胞内で生命活動に必須のエネルギー生産を担っており、細胞にとってもヒトの健康にとっても重要な役割を果たしています。ミトコンドリアが正常に機能するためには、エネルギーの通貨であるATPや様々な代謝物質をミトコンドリアの中から外に送り出したり取り込んだり、さらにはミトコンドリアを構成するタンパク質をミトコンドリアの中に取り込むための孔となる円筒形(バレル型)の膜タンパク質(β-バレル型膜タンパク質(注2))が外膜に存在することが必須です。このβ-バレル型膜タンパク質を外膜に組み込む装置として働くのが、複数のタンパク質が組み合わさってできたSAM複合体(注3)です。今回、本研究グループは、2種類のサブユニット組成から成るSAM複合体の精密構造をクライオ電子顕微鏡を用いた単粒子解析法(注4)で決定しました。その構造からSam50a、 Sam50b、 Sam35、 Sam37から成るSAMdimer複合体のSam50bが基質となるβ-バレル型膜タンパク質と入れ替わり、Sam50bと同じようなバレル型構造をつくると、今度は別のサブユニットのβ-バレル型膜タンパク質であるMdm10のバレル型構造が基質と入れ替わることで、バレル型構造が完成した基質がSAM複合体から解離することがわかりました。Mdm10が再びSam50bと入れ替わると反応サイクルの初期状態に戻ることになります。SAM複合体はこのようにダイナミックに構成サブユニットと基質を入れ替えることで、基質のバレル型構造の形成を促すことが明らかになりました。
背景
ヒトや酵母などの真核生物の細胞内には、ミトコンドリアをはじめとする膜で仕切られた細胞内小器官(オルガネラ)が存在します。ミトコンドリアは細胞内で生命活動に必要なエネルギーを産生します。そのため、ヒトではミトコンドリアが正常に機能することが健康につながり、ミトコンドリアの機能低下は老化や神経変性疾患をはじめとするさまざまな病態と関連することが知られています。ミトコンドリアは外膜と内膜の二枚の生体膜に囲まれ、1000種類以上のタンパク質から構成されており、これらのタンパク質のほとんどは、ミトコンドリアの外で合成されてからミトコンドリア内へと搬入されますが、この搬入のためにはタンパク質が通る孔が必要です。さらにミトコンドリアが正常に機能するためには、ミトコンドリア内で産生されたエネルギーの通貨であるATPや様々な代謝物質をミトコンドリアの中から外に送り出したり取り込んだりする孔も必要です。これらの孔は外膜で円筒形(バレル型)の膜タンパク質(β-バレル型膜タンパク質)がつくっています。
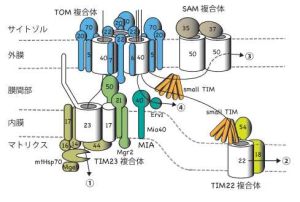
アミノ酸がつながったヒモであるタンパク質からどのようにバレル型の形をつくるのでしょうか。バレル型構造をつくるためには、タンパク質のヒモを端からジグザグに折りたたんでβ-シートという構造をつくり(ジグザグ型の1本1本をβ-ストランドと呼びます)、これを巻き上げてバレル型にします。ミトコンドリアにはβ-バレル型膜タンパク質が5種類存在しますが、Sam50 は16本のβ-ストランドが折りたたまれてバレル型シートをつくり、それ以外のβ-バレル型膜タンパク質は19本のβ-ストランドが折りたたまれてバレル型シートをつくることが知られています。こうしたバレル型構造の形成と同時に、このバレル型構造は脂質二分子膜から成る外膜に組み込まれねばなりません。β-バレル型膜タンパク質は外膜の搬入口であるTOM複合体(を構成するβ-バレル型膜タンパク質のTom40が作る孔)を通って膜間部に入ります。そこから外膜のSAM複合体と呼ばれるβ-バレル型膜タンパク質の組み込み装置の働きで、膜間部側から外膜にバレル型構造をつくって組み込まれると考えられています(図1)。しかし、これまでSAM複合体は高分解能の精密構造が決定されておらず、SAM複合体がどのようにβ-バレル型膜タンパク質を外膜に組み込んでいくのかは分かっていませんでした。
アミノ酸がつながったヒモであるタンパク質からどのようにバレル型の形をつくるのでしょうか。バレル型構造をつくるためには、タンパク質のヒモを端からジグザグに折りたたんでβ-シートという構造をつくり(ジグザグ型の1本1本をβ-ストランドと呼びます)、これを巻き上げてバレル型にします。ミトコンドリアにはβ-バレル型膜タンパク質が5種類存在しますが、Sam50 は16本のβ-ストランドが折りたたまれてバレル型シートをつくり、それ以外のβ-バレル型膜タンパク質は19本のβ-ストランドが折りたたまれてバレル型シートをつくることが知られています。こうしたバレル型構造の形成と同時に、このバレル型構造は脂質二分子膜から成る外膜に組み込まれねばなりません。β-バレル型膜タンパク質は外膜の搬入口であるTOM複合体(を構成するβ-バレル型膜タンパク質のTom40が作る孔)を通って膜間部に入ります。そこから外膜のSAM複合体と呼ばれるβ-バレル型膜タンパク質の組み込み装置の働きで、膜間部側から外膜にバレル型構造をつくって組み込まれると考えられています(図1)。しかし、これまでSAM複合体は高分解能の精密構造が決定されておらず、SAM複合体がどのようにβ-バレル型膜タンパク質を外膜に組み込んでいくのかは分かっていませんでした。
研究成果
クライオ電子顕微鏡(Cryo-EM)によるSAM複合体の精密構造決定
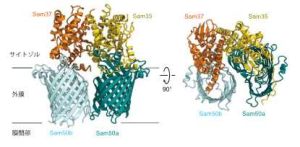
本研究グループは、酵母細胞からSAM複合体を精製し、東京大学のクライオ電子顕微鏡を用いてその構造を2.9Åの分解能で決定しました(SAMdimer複合体、図2)。全体構造はSam50(これもβ-バレル型膜タンパク質)2個、Sam35が1個、Sam37が1個から成る複合体でした。2分子のSam50(Sam50a, Sam50b)が作るバレル型構造が22°傾いて並び、その上(サイトゾル側)からSam35とSam37がよく似た構造をつくって蓋をする形になっていました。2分子のSam50(Sam50a, Sam50b)はバレル型構造が完全に閉じていない「オープン型」でした。Sam50aとSam50bの間に相互作用はほとんどなく、その位置決めはSam35とSam37が担っていました。本論文に先だって、Sam50, Sam37, Sam35が1分子ずつから構成されるSAMcore複合体のクライオEM構造が米国のグループから報告されましたが、われわれは、ミトコンドリア上にはSAMcore複合体だけでなくSAMdimer複合体が存在することを生化学的実験から証明しました。
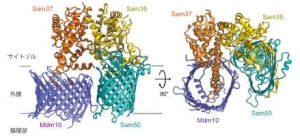
外膜のタンパク質搬入口TOM複合体の孔をつくるTom40(これもβ-バレル型膜タンパク質)がSAM複合体によってバレル型構造をつくって外膜に組み込まれるためには、Sam50, Sam35, Sam37以外にやはりβ-バレル型膜タンパク質のMdm10を必要とすることが分かっていますが、具体的なメカニズムは不明でした。そこで酵母細胞からMdm10を含むSAM複合体を精製し、やはり東京大学のクライオ電子顕微鏡を用いてその構造を2.8-3.2Åの分解能で決定しました(SAMMdm10複合体、図3)。SAMMdm10複合体はSam50, Mdm10, Sam35, Sam37が各々1分子ずつから構成され、SAMdimer複合体のSam50bの位置にMdm10がバレル型の構造をつくって結合していました。しかしMdm10はSAMdimer複合体のSam50bと異なり、バレル型構造がきれいに閉じた形(クローズ型)になっていました。
生化学的実験から、基質のβ-バレル型膜タンパク質のβ-ストランドが1本ならば、SAM複合体上にSam50a, Sam50b, バレル型構造を形成する途上の基質のβ-バレル型膜タンパク質が共存できますが、基質がβ-ストランド7本以上シートをつくると、SAM複合体上に基質タンパク質とSam50bは共存できないことがわかりました。また基質のβ-バレル型膜タンパク質がSAM複合体に結合しているときは、Mdm10はSAM複合体に結合できないことが分かりました。
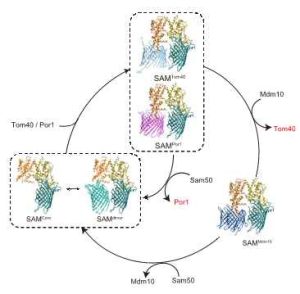
以上、今回明らかになったSAMdimer複合体、SAMMdm10複合体の構造から、β-バレル型膜タンパク質がバレル型構造をつくって膜に組み込まれるプロセスについて、図4のようなモデルを提案しました。SAM複合体はSam50が1分子のSAMcore複合体と2分子のSAMdimer複合体の平衡にあります。ここにTom40のような基質となるβ-バレル型膜タンパク質が膜間部側から来ると、Sam50bがSAM複合体からはずれ、Sam50bの位置に基質が入ります。そこで基質はβ-ストランドを1本ずつ折りたたみ、バレル型のシートをつくっていきます。バレル型構造が完成するとTom40の位置にバレル型のMdm10が入り込むことで、Tom40のバレル型構造をSAM複合体から追い出します。こうしてできたSAMMdm10複合体はMdm10とSam50bが入れ替わることで、再びSAMdimer複合体となって反応サイクルの最初の状態に戻ります。一方バレル型構造が完成して外膜に組み込まれたTom40は他のサブユニットとともにTOM複合体を形成することになります。このようにSAM複合体はSam50a, Sam35, Sam37がコアとなる構造をつくり、Sam50bの位置に基質のβ-バレル型膜タンパク質、Mdm10が入れ替わりに入ることで、基質がバレル型の構造をつくることを促すこと、Sam50bの位置がバレル型構造をつくる鋳型として働くことがはじめて明らかになりました。
本研究グループは、酵母細胞からSAM複合体を精製し、東京大学のクライオ電子顕微鏡を用いてその構造を2.9Åの分解能で決定しました(SAMdimer複合体、図2)。全体構造はSam50(これもβ-バレル型膜タンパク質)2個、Sam35が1個、Sam37が1個から成る複合体でした。2分子のSam50(Sam50a, Sam50b)が作るバレル型構造が22°傾いて並び、その上(サイトゾル側)からSam35とSam37がよく似た構造をつくって蓋をする形になっていました。2分子のSam50(Sam50a, Sam50b)はバレル型構造が完全に閉じていない「オープン型」でした。Sam50aとSam50bの間に相互作用はほとんどなく、その位置決めはSam35とSam37が担っていました。本論文に先だって、Sam50, Sam37, Sam35が1分子ずつから構成されるSAMcore複合体のクライオEM構造が米国のグループから報告されましたが、われわれは、ミトコンドリア上にはSAMcore複合体だけでなくSAMdimer複合体が存在することを生化学的実験から証明しました。
外膜のタンパク質搬入口TOM複合体の孔をつくるTom40(これもβ-バレル型膜タンパク質)がSAM複合体によってバレル型構造をつくって外膜に組み込まれるためには、Sam50, Sam35, Sam37以外にやはりβ-バレル型膜タンパク質のMdm10を必要とすることが分かっていますが、具体的なメカニズムは不明でした。そこで酵母細胞からMdm10を含むSAM複合体を精製し、やはり東京大学のクライオ電子顕微鏡を用いてその構造を2.8-3.2Åの分解能で決定しました(SAMMdm10複合体、図3)。SAMMdm10複合体はSam50, Mdm10, Sam35, Sam37が各々1分子ずつから構成され、SAMdimer複合体のSam50bの位置にMdm10がバレル型の構造をつくって結合していました。しかしMdm10はSAMdimer複合体のSam50bと異なり、バレル型構造がきれいに閉じた形(クローズ型)になっていました。
生化学的実験から、基質のβ-バレル型膜タンパク質のβ-ストランドが1本ならば、SAM複合体上にSam50a, Sam50b, バレル型構造を形成する途上の基質のβ-バレル型膜タンパク質が共存できますが、基質がβ-ストランド7本以上シートをつくると、SAM複合体上に基質タンパク質とSam50bは共存できないことがわかりました。また基質のβ-バレル型膜タンパク質がSAM複合体に結合しているときは、Mdm10はSAM複合体に結合できないことが分かりました。
以上、今回明らかになったSAMdimer複合体、SAMMdm10複合体の構造から、β-バレル型膜タンパク質がバレル型構造をつくって膜に組み込まれるプロセスについて、図4のようなモデルを提案しました。SAM複合体はSam50が1分子のSAMcore複合体と2分子のSAMdimer複合体の平衡にあります。ここにTom40のような基質となるβ-バレル型膜タンパク質が膜間部側から来ると、Sam50bがSAM複合体からはずれ、Sam50bの位置に基質が入ります。そこで基質はβ-ストランドを1本ずつ折りたたみ、バレル型のシートをつくっていきます。バレル型構造が完成するとTom40の位置にバレル型のMdm10が入り込むことで、Tom40のバレル型構造をSAM複合体から追い出します。こうしてできたSAMMdm10複合体はMdm10とSam50bが入れ替わることで、再びSAMdimer複合体となって反応サイクルの最初の状態に戻ります。一方バレル型構造が完成して外膜に組み込まれたTom40は他のサブユニットとともにTOM複合体を形成することになります。このようにSAM複合体はSam50a, Sam35, Sam37がコアとなる構造をつくり、Sam50bの位置に基質のβ-バレル型膜タンパク質、Mdm10が入れ替わりに入ることで、基質がバレル型の構造をつくることを促すこと、Sam50bの位置がバレル型構造をつくる鋳型として働くことがはじめて明らかになりました。
今後の展開
本研究でSAM複合体に基質が結合する前(SAMdimer複合体)と後(SAMMdm10複合体)のSAM複合体の二つの精密構造が明らかになり、β-バレル型膜タンパク質がSAM複合体により、バレル型構造をつくって膜に組み込まれるプロセスの鍵となる部分、Sam50b, 基質、Mdm10が相互に入れ替わることが分かりました。実際にSAM複合体に基質のβ-バレル型膜タンパク質が結合して、バレル型構造をつくる詳細なプロセスについては、今後の課題となります。本研究で解析した酵母SAM複合体は、ヒト細胞でも同じメカニズムでβ-バレル型膜タンパク質の組み込み装置として働くと考えられています(ただしヒトではSam50は保存されていますが、Sam35とSam37は別のサブユニットに置き換わっています)。したがってSAM複合体の機能欠損を解析することにより、今後ミトコンドリアへの物質の取り込みや送り出しに関わる孔をつくるβ-バレル型膜タンパク質と病気の関係などが明らかになっていくことが考えられます。将来的には、ミトコンドリア外膜の孔をつくるプロセスの効率の制御により、ミトコンドリア機能や細胞機能を制御することで、未開発だったミトコンドリアの欠損に伴う病態の治療法開発に道筋をつけることや老化の予防につながることも期待されます。
用語・事項の解説
1 ミトコンドリア
酵母からヒトまで広く真核生物の細胞内に見られる必須の細胞内小器官。生命活動に必要なエネルギー(ATP)を酸素呼吸によって産生するほか、さまざまな物質の代謝やアポトーシス(細胞死)にも関わる。ミトコンドリアの機能低下や機能異常と、老化やがん、糖尿病、さまざまなミトコンドリア病との関連が分かっている。ミトコンドリアの機能を健全に保つことがヒトの健康に重要であることから、異常ミトコンドリアを除去する方法や健全なミトコンドリアを増やす方法の開発が注目されている。
2 β-バレル型膜タンパク質
タンパク質のポリペプチド鎖が折り返して順次逆平行に並んでいくことで作られるβ-シートという二次構造をつくることができる。このβ-シートが円筒形(バレル型)に丸まって作られるタンパク質をβ-バレルタンパク質という。このときバレル型構造の外側が疎水性、内側が親水性になることで、生体膜に埋め込まれるタイプの膜タンパク質をβ-バレル型膜タンパク質という。ほとんどの膜タンパク質はらせん状の二次構造である疎水性αーヘリックスから組み立てられているので、β-バレル型膜タンパク質は例外的な膜タンパク質ということになる。細菌の外膜には様々なβ-バレル型膜タンパク質が存在し、細胞外からの物質の取り込みなどの役割を担っている。真核生物では細菌に起源をもつミトコンドリアと葉緑体の外膜にβ-バレル型膜タンパク質が存在し、やはりミトコンドリアや葉緑体の内外の物質の出入りを担っている。
3 SAM複合体
ミトコンドリアの外膜にβ-バレル型膜タンパク質を組み込む装置として働く膜タンパク質複合体。酵母ではβ-バレル膜タンパク質のSam50とSam35, Sam37から構成されるが、ヒトなど哺乳動物のミトコンドリアではSam50とメタキシンから構成される。細菌の外膜でβ-バレル型膜タンパク質を組み込む装置はBAM複合体であり、その中心サブユニットのBamA(β-バレル型膜タンパク質)とSam50は進化的に類似しているが、他のサブユニットは異なる。
4 クライオ電子顕微鏡による単粒子解析法
生体試料を液体窒素(-196℃)冷却下で急速凍結して電子線を照射し、生体分子を染色することなく電子顕微鏡で観察する(クライオ電子顕微鏡法)。これまでの精密構造決定の主役であったX線構造解析には試料の結晶化が必須だったが、良質のデータの高感度取得法および大量の画像データから三次元構造を再構成する手法(単粒子解析法)の開発により、結晶化しない生体試料でも解像度3Å程度の構造を決定することができるようになった。この方法の進展により、これまで結晶化が困難であったタンパク質の巨大複合体や膜タンパク質の構造解析が急速に進むようになった。2017年に、その開発に貢献した研究者3名がノーベル化学賞を受賞している。
論文情報
| タイトル | Mitochondrial sorting and assembly machinery operates by β-barrel switching (ミトコンドリアのSAM複合体はβバレルタンパク質の交換を介して機能する) |
|---|---|
| 掲載誌 | 英国科学誌「Nature」(オンライン版) |
| 掲載日 | 2021年1月7日(木)(日本時間) |
| 著者 | 竹田弘法1、鈴木純子、遠藤斗志也2(京都産業大学) 包明久、吉川雅英、西澤知宏、濡木 理(東京大学) 今井賢一郎、山守 優、富井健太郎(産業技術総合研究所) 小笠原 諭、村田武士(千葉大学) Caroline Lindau, Jon V. Busto, Lena-Sophie Wenz, Lars Ellenrieder, Sebastian P. Straub, Waltraut Mossmann, Jian Qiu, Thomas Becker、Nils Wiedemann、Nikolaus Pfanner(ドイツ・フライブルグ大学) (1筆頭著者、2責任著者)(研究当時) |
| DOI | doi: 10.1038/s41586-020-03113-7 |