【生命科学部】小胞体ジスルフィド還元酵素ERdj5の電子ドナータンパク質として小胞体酸化酵素Ero1αを同定し、小胞体への新たな還元力供給機構を解明
京都産業大学の永田 和宏名誉教授、生命科学部 潮田 亮准教授、生命科学研究科大学院生の上垣 日育らの研究グループは、小胞体内腔でジスルフィド還元酵素として機能するERdj5へ還元力を供給する新たな還元力供給機構を解明しました。この発見は、小胞体内腔の恒常性破綻に起因する神経変性疾患、糖尿病などさまざまな疾患など、新たな切り口での治療法開発に期待ができる成果です。
研究のポイント
- 酸化的な小胞体で、どのように還元酵素ERdj5*1が還元活性を持つのかは不明であった。
- 小胞体ジスルフィド還元酵素ERdj5の電子ドナータンパク質として小胞体酸化酵素Ero1α*2を同定した。
- ERdj5の還元力(電子)は、PDI*3-Ero1α複合体による新生ポリペプチド鎖*4の酸化的フォールディング*5から供給される。
- ERdj5はEro1αから電子を奪うことで、酸化ストレス*6の原因となる過酸化水素(H2O2)の産生を抑える。
概要
京都産業大学の永田 和宏名誉教授、生命科学部 潮田 亮准教授、生命科学研究科大学院生の上垣 日育らの研究グループは、小胞体内腔でジスルフィド還元酵素として機能するERdj5へ還元力を供給する新たな還元力供給機構を解明しました。この発見は、小胞体内腔の恒常性破綻に起因する神経変性疾患、糖尿病などさまざまな疾患など、新たな切り口での治療法開発に期待ができる成果です。
本研究の成果は2023年7月25日(火)(米国東部時間 午前11:00)に米国科学雑誌(Cell Reports)のオンライン速報版で公開されます。
背景
生命において、酸化還元(レドックス)反応は細胞内のさまざまな生命現象を支える重要な反応です。細胞小器官の一つである小胞体は、分泌タンパク質の合成の場であり、そのタンパク質の折りたたみ(フォールディング)には、酸化反応が欠かせません。酸化反応はタンパク質のシステイン残基*7間で架橋されるジスルフィド結合形成を触媒し、この形成によって、タンパク質の立体構造形成や複合体形成が促されます。また、ジスルフィド結合形成を伴ったタンパク質フォールディングは酸化的フォールディングと呼ばれ、小胞体における酸化的フォールディングは、主にPDI-Ero1α複合体による酸化反応によって効率的に促進されます。(図1、酸化反応)。この酸化的フォールディングによって、基質から放出された電子はPDI-Ero1α複合体を介して分子状酸素(O2)へ受け渡され、酸化ストレスの原因となるH2O2の産生に消費されることが、これまで知られていました。このように小胞体は、サイトゾルと比較してタンパク質の酸化反応に適したレドックス環境にあります。一方、永田・潮田らの研究グループは、酸化的なレドックス環境である小胞体内腔において、ジスルフィド結合の切断(還元反応)を促進する還元酵素としてERdj5を世界で初めて同定し、ERdj5による還元反応が小胞体で間違って折りたたまれたタンパク質(ミスフォールドタンパク質)の分解やカルシウムイオン濃度調節に必要不可欠であることを明らかにしてきました(図1:還元反応)。しかし、ERdj5が小胞体内腔で還元酵素として働くためには、還元力(電子)の供給が不可欠であり、ERdj5が同定されて以来、小胞体への還元力供給機構は、細胞生物学における根本的な謎の一つとされてきました。本研究では、ERdj5の電子ドナータンパク質を同定し、小胞体への還元力供給機構を明らかにしました。
研究成果
永田・潮田らの研究グループは、さまざまな分子生物学・生化学的実験を駆使し、ジスルフィド還元酵素ERdj5の電子ドナータンパク質として小胞体酸化酵素Ero1αを同定し、ERdj5がPDI-Ero1α複合体による新生ポリペプチド鎖の酸化的フォールディングから還元力を獲得することを明らかにしました。従来、小胞体に輸送された新生ポリペプチド鎖の酸化的フォールディングで生じた電子は、PDI-Ero1α複合体を介してO2へ受け渡され、その大部分の電子が酸化ストレスの原因となるH2O2の産生に消費されることが常識として知られていました(図2:青矢印、図3:人の手から溢れ、排水口へ流れる水道水)。しかし、本研究成果によって、還元酵素ERdj5がPDI-Ero1α複合体からH2O2産生に消費される電子の一部を奪い、自身の還元力として再利用していることがわかり、リボソームの翻訳と共役した新しい小胞体への還元力供給機構が明らかになりました(図2:赤矢印、図3:ネコが人の手に溜まった水道水を飲む様子)。さらに、この新たな電子伝達経路は、Ero1αが生み出す過剰なH2O2産生を抑え、小胞体のレドックス恒常性維持に寄与していることも明らかにしました。
今後の展開
これまで我々は、ERdj5を介した還元反応が小胞体におけるタンパク質分解経路やカルシウムイオン濃度調節を介して小胞体の恒常性維持に必要不可欠であることを証明してきました。今回、明らかにしたERdj5への電子供給機構はこれらの反応を支えるものです。小胞体内腔の恒常性破綻は小胞体ストレスに起因する神経変性疾患、糖尿病などさまざまな疾患の原因となります。小胞体内腔の還元反応に着目したこれら疾患の治療法開発は例がなく、新たな切り口での治療法として期待ができます。また、小胞体内腔におけるH2O2の過剰な産生は、小胞体のレドックス環境だけでなく、サイトゾルのレドックス環境も破綻させ、酸化ストレスを引き起こすことが報告されています。今回、発見したERdj5への新たな電子伝達経路は小胞体酸化酵素Ero1αから電子を奪い、小胞体内腔のH2O2産生を抑制する効果があり、酸化ストレスによる老化や関連疾患の発症機構の解明につながる可能性が期待されます。
一方、Ero1αがどのように自身の分子内電子伝達経路をERdj5への電子伝達経路に変化させているかは不明な点が多く、その詳細なメカニズムは未解明のままです。現在、Ero1αへのERdj5の結合がEro1αの電子伝達経路を変化させていると仮説立て、その詳細な分子メカニズムについて調査を進めています。小胞体のレドックス環境がどのように構築されているかを正しく理解し、レドックス制御を介した新しい小胞体の恒常性維持機構の解明を目指しています。
用語・事項の解説
*1. ERdj5
哺乳類細胞の小胞体内腔で初めて見つかったジスルフィド還元酵素。タンパク質のジスルフィド結合を切断する活性をもつ。その還元活性により、小胞体の恒常性維持に貢献している。
*2. Ero1α
小胞体内腔の酸化反応ネットワークの中枢を担う酸化酵素。基質のジスルフィド結合形成を触媒するPDIと複合体を形成し、小胞体に輸送された新生ポリペプチド鎖の酸化的フォールディングを促進する。このとき、Ero1αは新生ポリペプチド鎖のジスルフィド結合形成で生じた電子をPDIから受け取り、分子状酸素(O2)へ放出し、酸化ストレスの原因となる過酸化水素(H2O2)を産生する。
*3. PDI
基質のジスルフィド結合形成を触媒する酸化酵素。基質から奪った電子をEro1αに放出することで、Ero1αを介してO2から酸化力を獲得し、基質の酸化反応のサイクルを繰り返す。
*4. 新生ポリペプチド鎖
タンパク質翻訳装置であるリボソームから一本のアミノ酸の鎖として合成されて間もない状態を指す。近年、構造を持つ前の新生ポリペプチド鎖が細胞内で多様な生命現象を制御していることが見出されている。
*5. 酸化的フォールディング
分子内または分子間ジスルフィド結合形成を伴うタンパク質のフォールディング。ジスルフィド結合はタンパク質の構造安定性や立体構造形成に重要な役割を果たす。小胞体では、主にPDIを代表とするPDIファミリータンパク質が基質のジスルフィド結合形成を触媒する。
*6. 酸化ストレス
H2O2に代表される活性酸素種によって惹起されるストレス。Ero1αから産生されるH2O2は小胞体内腔からサイトゾルへ漏洩し、酸化ストレスの引き金となると考えられている。
*7. システイン残基
タンパク質を構成するアミノ酸の一つ。側鎖に硫黄原子を含んだチオール基をもち、化学反応性に富む。また、システイン残基同士でジスルフィド結合と呼ばれる共有結合を形成する。
参考図
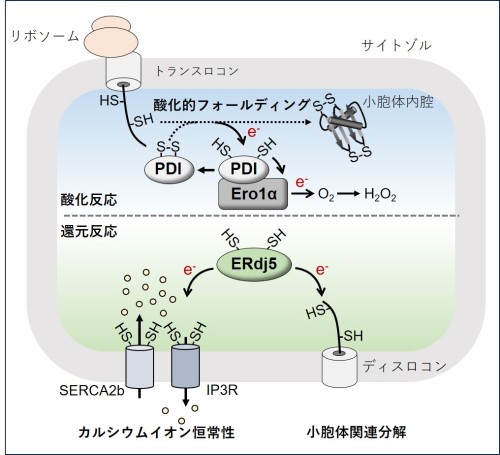 図1:レドックス制御を介した小胞体の恒常性維持機構
リボソームから合成された新生ポリペプチド鎖は小胞体に輸送されると、PDI-Ero1α複合体を介した酸化的フォールディングによりジスルフィド結合が形成され、成熟タンパク質へと折りたたまれる。このとき、PDIは基質から電子(e-)を奪い、Ero1αに電子を受け渡す。Ero1αは受け取った電子を分子状酸素(O₂)に放出し、過酸化水素(H₂O₂)を産生する。一方、ERdj5は小胞体で折りたたみに失敗したタンパク質(ミスフォールドタンパク質)のジスルフィド結合を還元し、その分解経路である小胞体関連分解に貢献している。また、ERdj5は小胞体膜にあるカルシウムイオン放出チャネルIP3受容体(IP3R)やカルシウムイオン輸送体SERCA2bのジスルフィド結合を還元し、それぞれのカルシウムイオン放出または輸送活性を制限することで、小胞体のカルシウムイオン恒常性維持にも寄与する。
図1:レドックス制御を介した小胞体の恒常性維持機構
リボソームから合成された新生ポリペプチド鎖は小胞体に輸送されると、PDI-Ero1α複合体を介した酸化的フォールディングによりジスルフィド結合が形成され、成熟タンパク質へと折りたたまれる。このとき、PDIは基質から電子(e-)を奪い、Ero1αに電子を受け渡す。Ero1αは受け取った電子を分子状酸素(O₂)に放出し、過酸化水素(H₂O₂)を産生する。一方、ERdj5は小胞体で折りたたみに失敗したタンパク質(ミスフォールドタンパク質)のジスルフィド結合を還元し、その分解経路である小胞体関連分解に貢献している。また、ERdj5は小胞体膜にあるカルシウムイオン放出チャネルIP3受容体(IP3R)やカルシウムイオン輸送体SERCA2bのジスルフィド結合を還元し、それぞれのカルシウムイオン放出または輸送活性を制限することで、小胞体のカルシウムイオン恒常性維持にも寄与する。
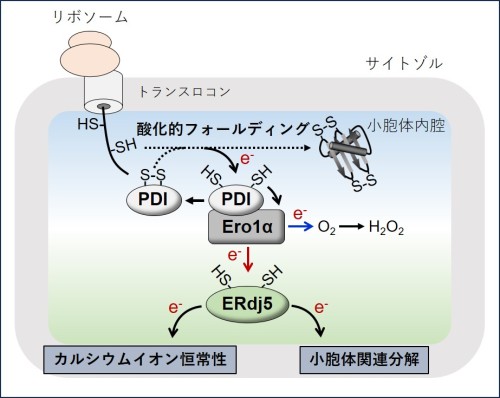 図2: リボソームの翻訳と共役した小胞体への新たな還元力供給機構
PDI-Ero1α複合体は小胞体に輸送された新生ポリペプチド鎖の酸化的フォールディングを促進し、新生ポリペプチド鎖から電子(e-)を奪う。奪った電子はEro1αを介して分子状酸素(O₂)に受け渡され、過酸化水素(H₂O₂)の産生に消費される(青矢印)。これが従来、知られていた電子伝達経路であったが、ERdj5はEro1αと結合することで、PDI-Ero1α複合体による酸化的フォールディングから生じた電子を受け取り、還元力を獲得する(赤矢印)。
図2: リボソームの翻訳と共役した小胞体への新たな還元力供給機構
PDI-Ero1α複合体は小胞体に輸送された新生ポリペプチド鎖の酸化的フォールディングを促進し、新生ポリペプチド鎖から電子(e-)を奪う。奪った電子はEro1αを介して分子状酸素(O₂)に受け渡され、過酸化水素(H₂O₂)の産生に消費される(青矢印)。これが従来、知られていた電子伝達経路であったが、ERdj5はEro1αと結合することで、PDI-Ero1α複合体による酸化的フォールディングから生じた電子を受け取り、還元力を獲得する(赤矢印)。
 図3: 本研究の成果を表現したイラスト
蛇口からとめどなく流れる水は、リボソームの翻訳によって合成された新生ポリペプチド鎖からの電子(e-)を意味しています。流れる水(電子)を受け取る飼い主の手は、PDI-Ero1α複合体を表現しています。大部分の水(電子)は分子状酸素(O₂)を意味する排水口に流れて消費されていきます。還元酵素ERdj5はネコで表現され、人の手からすくわれた一部の水(電子)を飲んで、自身の還元力に利用しています。このイラストは、イラストレーターのウチダヒロコさんによって制作されました。
図3: 本研究の成果を表現したイラスト
蛇口からとめどなく流れる水は、リボソームの翻訳によって合成された新生ポリペプチド鎖からの電子(e-)を意味しています。流れる水(電子)を受け取る飼い主の手は、PDI-Ero1α複合体を表現しています。大部分の水(電子)は分子状酸素(O₂)を意味する排水口に流れて消費されていきます。還元酵素ERdj5はネコで表現され、人の手からすくわれた一部の水(電子)を飲んで、自身の還元力に利用しています。このイラストは、イラストレーターのウチダヒロコさんによって制作されました。
論文情報
| 論文タイトル |
「The oxidative folding of nascent polypeptides provides electrons for reductive reactions in the ER」
(新生ポリペプチド鎖の酸化的フォールディングが小胞体内腔における還元反応へ電子を供給する)
|
| 掲載誌 |
米国科学雑誌(Cell Reports)(オンライン版) |
| 掲載日 |
2023年7月25日(火)(米国東部時間 午前11:00) |
| 著者 |
上垣日育1, a、徳永裕二e、井上道雄f、高島成二g、稲葉謙次f、竹内恒e、潮田亮2, b, d、
永田和宏2, c, d
(1筆頭著者、2責任著者)
(所属 : a. 京都産業大学大学院生命科学研究科、b. 京都産業大学生命科学部、c. 京都産業大学、d. 京都産業大学タンパク質動態研究所、e. 東京大学大学院薬学系研究科、f. 東北大学多元物質科学研究所、g. 大阪大学大学院医学系研究科)
|
| DOI |
10.1016/j.celrep.2023.112742 |
謝辞
本研究は、科学技術振興機構における戦略的創造研究推進事業JST-CREST「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域 研究課題名「小胞体恒常性維持機構:Redox, Ca2+, タンパク質品質管理のクロストーク」(課題番号:JPMJCR13M6 研究代表者:永田 和宏)、新学術領域研究(研究領域提案型)「新生鎖の生物学」研究領域(課題番号:26116001 研究代表者:田口 英樹 研究分担者:稲葉 謙次)、新学術領域研究(研究領域提案型)「新生鎖の生物学」研究領域 研究課題名「新生鎖による小胞体レドックス制御-新生鎖による還元力の獲得」(課題番号:15H01545 研究代表者:潮田 亮)、新学術領域研究(研究領域提案型)「細胞機能を司るオルガネラ・ゾーンの解読」研究領域 研究課題名「レドックスゾーンで切り拓く小胞体恒常性維持機構」(課題番号:18H04871 研究代表者:潮田 亮)、科学研究費補助事業における学術変革領域研究(A)「新興硫黄生物学が拓く生命原理変革」研究領域 研究課題名「タンパク質品質管理を支える電子移動媒体としての超硫黄分子の役割」(課題番号:21H05268 研究代表者:潮田 亮)、科研費「基盤研究(S)(課題番号:24227009 研究代表者:永田 和宏)」、科研費「基盤研究(A)(課題番号:18H03978 研究代表者:稲葉 謙次)」、科研費「基盤研究(B)(課題番号:JP22H02622 研究代表者:潮田 亮)」、科研費「基盤研究(C)(課題番号:JP18K06140 研究代表者:潮田 亮)」、日本医療研究開発機構(AMED)における革新的先端研究開発支援事業AMED-CREST「プロテオスタシスの理解と革新的医療の創出」研究領域 研究課題名「プロテオスタシスにおけるタンパク質構造形成機構の包括的解明」(課題番号:JP21GM1410008 研究代表者:田口 英樹 研究分担者:潮田 亮)、科研費「特別研究員(DC1)(課題番号:17J05866 研究代表者:上垣 日育)」および武田科学振興財団の支援により実施されました。



