酸化ストレスによる老化や関連疾患の発症機構の解明につながる可能性に期待小胞体ジスルフィド還元酵素ERdj5の電子ドナータンパク質として小胞体酸化酵素Ero1αを同定し、小胞体への新たな還元力供給機構を解明
2023.07.26
京都産業大学の永田和宏名誉教授、生命科学部の潮田亮准教授、生命科学研究科大学院生の上垣日育らの研究グループは、小胞体内腔でジスルフィド還元酵素として機能するERdj5へ還元力を供給する新たな還元力供給機構を解明しました。この発見は、小胞体内腔の恒常性破綻に起因する神経変性疾患、糖尿病など様々な疾患など、新たな切り口での治療法開発に期待ができる成果です。本研究の成果は、米国科学雑誌(Cell Reports)のオンライン速報版で公開されます。
リリース日:2023-07-26
蛇口からとめどなく流れる水は、リボソームの翻訳によって合成された新生ポリペプチド鎖からの電子(e-)を意味しています。流れる水(電子)を受け取る飼い主の手は、PDI-Ero1α複合体を表現しています。大部分の水(電子)は分子状酸素(O2)を意味する排水口に流れて消費されていきます。還元酵素ERdj5はネコで表現され、人の手からすくわれた一部の水(電子)を飲んで、自身の還元力に利用しています。このイラストは、イラストレーターのウチダヒロコさんによって制作されました。
本件のポイント
- 酸化還元(レドックス)反応は、細胞内の様々な生命現象をつかさどるタンパク質の恒常性(プロテオスタシス)においても重要な役割を果たしているが、酸化的な小胞体で、どのように還元酵素ERdj5(哺乳類細胞の小胞体内腔で初めて見つかったジスルフィド還元酵素。タンパク質のジスルフィド結合を切断する活性をもつ。その還元活性により、小胞体の恒常性維持に貢献している)が還元活性を持つのかは不明であった。
- 永田・潮田らの研究グループは、酸化的なレドックス環境である小胞体内腔において、ジスルフィド結合の切断(還元反応)を促進する還元酵素としてERdj5を世界で初めて同定し、ERdj5による還元反応が小胞体のプロテオスタシス維持やカルシウムイオン濃度調節に必要不可欠であることを明らかにしてきた。しかし、ERdj5が小胞体内腔で還元酵素として働くためには、還元力(電子)の供給が不可欠であり、ERdj5が同定されて以来、小胞体への還元力供給機構は、細胞生物学における根本的な謎の一つとされてきたが、本研究では、ERdj5の電子ドナータンパク質を同定し、小胞体への還元力供給機構を明らかにした。
- これまで、ERdj5を介した還元反応がプロテオスタシス維持やカルシウムイオン濃度調節を介して小胞体環境の恒常性維持に必要不可欠であることがわかっている。今回、明らかにしたERdj5への電子供給機構は、これらの反応を支えるもので、小胞体内腔の恒常性破綻は小胞体ストレスに起因する神経変性疾患、糖尿病など様々な疾患の原因となりえる。しかし、小胞体内腔の還元反応に着目したこれら疾患の治療法開発は例がなく、新たな切り口での治療法として期待ができる。今後、小胞体のレドックス環境がどのように構築されているかを正しく理解し、レドックス制御を介した新しい小胞体の恒常性維持機構に迫ることを目指していく。
研究のポイント
- 酸化的な小胞体で、どのように還元酵素ERdj5*1 が還元活性を持つのかは不明であった。
- 小胞体ジスルフィド還元酵素ERdj5の電子ドナータンパク質として小胞体酸化酵素Ero1α*2を同定した。
- ERdj5の還元力(電子)は、PDI*3-Ero1α複合体による新生ポリペプチド鎖I*4の酸化的フォールディング*5から供給される。
- ERdj5はEro1αから電子を奪うことで、酸化ストレス*6の原因となる過酸化水素(H2O2)の産生を抑える。
概要
京都産業大学、永田和宏名誉教授、生命科学部潮田亮准教授、生命科学研究科大学院生の上垣日育らの研究グループは、小胞体内腔でジスルフィド還元酵素として機能するERdj5へ還元力を供給する新たな還元力供給機構を解明しました。この発見は、小胞体内腔の恒常性破綻に起因する神経変性疾患、糖尿病など様々な疾患など、新たな切り口での治療法開発に期待ができる成果です。
本研究の成果は2023年7月25日(火)(午前11:00)(米国東部時間) に米国科学雑誌(Cell Reports)のオンライン速報版で公開されます。
本研究の成果は2023年7月25日(火)(午前11:00)(米国東部時間) に米国科学雑誌(Cell Reports)のオンライン速報版で公開されます。
背景
酸化還元(レドックス)反応は、細胞内の様々な生命現象を司るタンパク質の恒常性(プロテオスタシス)においても重要な役割を果たしています。タンパク質のシステイン残基*7間で架橋されるジスルフィド結合形成は、タンパク質の立体構造形成(フォールディング)や複合体形成に必要で、酸化反応になります。リボソームから合成される新生ポリペプチド鎖の約1/3は、細胞小器官の1つである小胞体へ運ばれ、主にPDI-Ero1α複合体による酸化反応によってジスルフィド結合が形成され、酸化的フォールディングが促進されます(図1、酸化反応)。また、この酸化的フォールディングによって、基質から奪われた電子はEro1αを介して分子状酸素(O2)へ受け渡され、酸化ストレスの原因となるH2O2の産生に消費されることが、これまで知られていました。このように小胞体は、サイトゾルと比較してタンパク質の酸化反応に適したレドックス環境にあります。一方、永田・潮田らの研究グループは、酸化的なレドックス環境である小胞体内腔において、ジスルフィド結合の切断(還元反応)を促進する還元酵素としてERdj5を世界で初めて同定し、ERdj5による還元反応が小胞体のプロテオスタシス維持やカルシウムイオン濃度調節に必要不可欠であることを明らかにしてきました(図1:還元反応)。しかし、ERdj5が小胞体内腔で還元酵素として働くためには、還元力(電子)の供給が不可欠であり、ERdj5が同定されて以来、小胞体への還元力供給機構は、細胞生物学における根本的な謎の一つとされてきました。本研究では、ERdj5の電子ドナータンパク質を同定し、小胞体への還元力供給機構を明らかにしました。
研究成果
ERdj5に還元力をもたらす電子ドナー候補タンパク質を探索するため、ERdj5の還元活性中心と特異的に結合するタンパク質を質量分析により同定し、その候補タンパク質の中から小胞体酸化酵素Ero1αに着目しました。Ero1αは、小胞体の代表的な酸化酵素であり、PDIと複合体を形成し、PDIを酸化することで、新生ポリペプチド鎖の酸化的フォールディングに関与します。酸化的フォールディングによって生じた電子はEro1αを介してO2へ受け渡され、酸化ストレスの原因となるH2O2の産生に消費されます。
タンパク質のレドックス状態を観察するため、ペグマレイミドシフトアッセイ*8を用い、Ero1αが及ぼすPDIおよびERdj5のレドックス状態への影響を調べました(図2)。以前の報告通り、PDIはEro1αによって酸化されることが示されました(図2A)。一方で、ERdj5はEro1αに還元されることがわかり(図2B)、Ero1αがERdj5の還元酵素として機能することが明らかになりました。また、蛍光顕微鏡を用いた生細胞H2O2イメージングにより(図3A)、ERdj5がEro1αから電子を奪うことで、小胞体のH2O2産生を抑制していることも見出しました(図3B)。さらに、リボソームの翻訳阻害剤シクロへキシミド(CHX)を用い、Ero1αの電子供給源である新生ポリペプチド鎖の合成を止め、ERdj5のレドックス状態を観察しました(図4A)。その結果、CHX処理時間依存的にERdj5のレドックス状態が還元型から酸化型へと移行しました。これらの研究成果から、永田・潮田らの研究グループはERdj5がPDI- Ero1α複合体による新生ポリペプチド鎖の酸化的フォールディングによって生じた電子を自身の還元力として利用することを明らかにしました(図4B)。
これまで小胞体への還元力供給機構について、小胞体膜タンパク質が分子内電子伝達あるいは低分子電子供与体の輸送を行うことで、還元的なレドックス環境であるサイトゾルから電子を供給し、小胞体内腔の還元反応に還元力がもたらされると想定されてきました。永田・潮田らの研究グループは、還元酵素ERdj5が小胞体内腔において新生ポリペプチド鎖の酸化的フォールディングに関与する酸化酵素Ero1αから電子を奪い、自身の還元力を獲得していることを明らかにしました(図5、6)。さらに、この電子伝達によって、Ero1αが生み出す過剰なH2O2産生を抑え、小胞体のレドックス恒常性維持に寄与していることも明らかにしました。
タンパク質のレドックス状態を観察するため、ペグマレイミドシフトアッセイ*8を用い、Ero1αが及ぼすPDIおよびERdj5のレドックス状態への影響を調べました(図2)。以前の報告通り、PDIはEro1αによって酸化されることが示されました(図2A)。一方で、ERdj5はEro1αに還元されることがわかり(図2B)、Ero1αがERdj5の還元酵素として機能することが明らかになりました。また、蛍光顕微鏡を用いた生細胞H2O2イメージングにより(図3A)、ERdj5がEro1αから電子を奪うことで、小胞体のH2O2産生を抑制していることも見出しました(図3B)。さらに、リボソームの翻訳阻害剤シクロへキシミド(CHX)を用い、Ero1αの電子供給源である新生ポリペプチド鎖の合成を止め、ERdj5のレドックス状態を観察しました(図4A)。その結果、CHX処理時間依存的にERdj5のレドックス状態が還元型から酸化型へと移行しました。これらの研究成果から、永田・潮田らの研究グループはERdj5がPDI- Ero1α複合体による新生ポリペプチド鎖の酸化的フォールディングによって生じた電子を自身の還元力として利用することを明らかにしました(図4B)。
これまで小胞体への還元力供給機構について、小胞体膜タンパク質が分子内電子伝達あるいは低分子電子供与体の輸送を行うことで、還元的なレドックス環境であるサイトゾルから電子を供給し、小胞体内腔の還元反応に還元力がもたらされると想定されてきました。永田・潮田らの研究グループは、還元酵素ERdj5が小胞体内腔において新生ポリペプチド鎖の酸化的フォールディングに関与する酸化酵素Ero1αから電子を奪い、自身の還元力を獲得していることを明らかにしました(図5、6)。さらに、この電子伝達によって、Ero1αが生み出す過剰なH2O2産生を抑え、小胞体のレドックス恒常性維持に寄与していることも明らかにしました。
今後の展開
これまで、ERdj5を介した還元反応がプロテオスタシス維持やカルシウムイオン濃度調節を介して小胞体環境の恒常性維持に必要不可欠であることがわかっています。今回、明らかにしたERdj5への電子供給機構は、これらの反応を支えるもので、小胞体内腔の恒常性破綻は小胞体ストレスに起因する神経変性疾患、糖尿病など様々な疾患の原因となりえます。しかし、小胞体内腔の還元反応に着目したこれら疾患の治療法開発は例がなく、新たな切り口での治療法として期待ができます。また、小胞体内腔におけるH2O2の過剰な産生は、小胞体のレドックス環境だけでなく、サイトゾルのレドックス環境も破綻させ、酸化ストレスを引き起こすことが報告されています。今回、発見したERdj5への新たな電子伝達経路は小胞体酸化酵素Ero1αから電子を奪い、小胞体内腔のH2O2産生を抑制する効果があり、酸化ストレスによる老化や関連疾患の発症機構の解明につながる可能性が期待されます。
一方、Ero1αがどのように自身の分子内電子伝達経路をERdj5への電子伝達経路に変化させているかは不明な点が多く、その詳細なメカニズムは未解明のままです。現在、Ero1αへのERdj5の結合がEro1αの電子伝達経路を変化させていると仮説立て、その詳細な分子メカニズムについて調査を進めています。その解明を通じて、小胞体のレドックス環境がどのように構築されているかを正しく理解し、レドックス制御を介した新しい小胞体の恒常性維持機構に迫ることを目指しています。
一方、Ero1αがどのように自身の分子内電子伝達経路をERdj5への電子伝達経路に変化させているかは不明な点が多く、その詳細なメカニズムは未解明のままです。現在、Ero1αへのERdj5の結合がEro1αの電子伝達経路を変化させていると仮説立て、その詳細な分子メカニズムについて調査を進めています。その解明を通じて、小胞体のレドックス環境がどのように構築されているかを正しく理解し、レドックス制御を介した新しい小胞体の恒常性維持機構に迫ることを目指しています。
謝辞
本研究は、科学技術振興機構における戦略的創造研究推進事業JST-CREST「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域 研究課題名「小胞体恒常性維持機構:Redox, Ca2+ , タンパク質品質管理のクロストーク」(課題番号:JPMJCR13M6 研究代表者:永田 和宏)、新学術領域研究(研究領域提案型)「新生鎖の生物学」研究領域(課題番号:26116001 研究代表者:田口 英樹 研究分担者:稲葉 謙次)、新学術領域研究(研究領域提案型)「新生鎖の生物学」研究領域 研究課題名「新生鎖による小胞体レドックス制御-新生鎖による還元力の獲得」(課題番号:15H01545 研究代表者:潮田 亮)、新学術領域研究(研究領域提案型)「細胞機能を司るオルガネラ・ゾーンの解読」研究領域 研究課題名「レドックスゾーンで切り拓く小胞体恒常性維持機構」(課題番号:18H04871 研究代表者:潮田 亮)、科学研究費補助事業における学術変革領域研究(A)「新興硫黄生物学が拓く生命原理変革」研究領域 研究課題名「タンパク質品質管理を支える電子移動媒体としての超硫黄分子の役割」(課題番号:21H05268 研究代表者:潮田 亮)、科研費「基盤研究(S)(課題番号:24227009 研究代表者:永田 和宏)」、科研費「基盤研究(A)(課題番号:18H03978 研究代表者:稲葉 謙次)」、科研費「基盤研究(B)(課題番号:JP22H02622 研究代表者:潮田 亮)」、科研費「基盤研究(C)(課題番号:JP18K06140 研究代表者:潮田 亮)」、日本医療研究開発機構(AMED)における革新的先端研究開発支援事業AMED-CREST「プロテオスタシスの理解と革新的医療の創出」研究領域 研究課題名「プロテオスタシスにおけるタンパク質構造形成機構の包括的解明」(課題番号:JP21GM1410008 研究代表者:田口 英樹 研究分担者:潮田 亮)、科研費「特別研究員(DC1)(課題番号:17J05866 研究代表者:上垣 日育)」および武田科学振興財団の支援により実施されました。
用語・事項の解説
*1.ERdj5: 哺乳類細胞の小胞体内腔で初めて見つかったジスルフィド還元酵素。タンパク質のジスルフィド結合を切断する活性をもつ。その還元活性により、小胞体の恒常性維持に貢献している。
*2.Ero1α:小胞体内腔の酸化反応ネットワークの中枢を担う酸化酵素。基質のジスルフィド結合形成を触媒するPDIと複合体を形成し、小胞体に挿入された新生ポリペプチド鎖の酸化的フォールディングを促進する。このとき、Ero1αは新生ポリペプチド鎖のジスルフィド結合形成で生じた電子をPDIから受け取り、分子状酸素(O2)へ放出し、酸化ストレスの原因となる過酸化水素(H2O2)を産生する。
*3.PDI:基質のジスルフィド結合形成を触媒する酸化酵素。基質から奪った電子をEro1αに放出することで、Ero1αを介してO2から酸化力を獲得し、基質の酸化反応のサイクルを繰り返す。
*4.新生ポリペプチド鎖タンパク質翻訳装置であるリボソームから一本のアミノ酸の鎖として合成されて間もない状態を指す。近年、構造を持つ前の新生ポリペプチド鎖が細胞内で多様な生命現象を制御していることが見出されている。
*5.酸化的フォールディング :分子内または分子間ジスルフィド結合形成を伴うタンパク質のフォールディング。ジスルフィド結合はタンパク質の構造安定性や立体構造形成に重要な役割を果たす。小胞体では、主にPDIを代表とするPDIファミリータンパク質が基質のジスルフィド結合形成を触媒する。
*6.酸化ストレス:H2O2に代表される活性酸素種によって惹起されるストレス。Ero1αから産生されるH2O2は小胞体内腔からサイトゾルへ漏洩し、酸化ストレスの引き金となると考えられている。
*7.システイン残基:タンパク質を構成するアミノ酸の一つ。側鎖に硫黄原子を含んだチオール基をもち、化学反応性に富む。また、システイン残基同士でジスルフィド結合と呼ばれる共有結合を形成する。
*8.ペグマレイミドシフトアッセイ:システイン残基のチオール基に対して特異的に結合し、修飾剤として機能するペグマレイミドを用い、タンパク質のレドックス状態を観察することができる実験手法。ペグマレイミドはポリエチレングリコールを意味するペグ部位とマレイミド基に分けることができ、マレイミド基がシステイン残基のチオール基に特異的な結合能をもつ。また、ペグ部位の分子量の大きさには種類がある。したがって、ペグ部位の大きさによるが、ペグマレイミドが修飾されたタンパク質は通常の分子量よりも大きくなり、結果として、SDS-PAGE電気泳動後において分子量の差異が生じる。本記事では、還元型のタンパク質にペグマレイミドが修飾されるため、還元型は分子量が酸化型と比較して大きくなる。
*2.Ero1α:小胞体内腔の酸化反応ネットワークの中枢を担う酸化酵素。基質のジスルフィド結合形成を触媒するPDIと複合体を形成し、小胞体に挿入された新生ポリペプチド鎖の酸化的フォールディングを促進する。このとき、Ero1αは新生ポリペプチド鎖のジスルフィド結合形成で生じた電子をPDIから受け取り、分子状酸素(O2)へ放出し、酸化ストレスの原因となる過酸化水素(H2O2)を産生する。
*3.PDI:基質のジスルフィド結合形成を触媒する酸化酵素。基質から奪った電子をEro1αに放出することで、Ero1αを介してO2から酸化力を獲得し、基質の酸化反応のサイクルを繰り返す。
*4.新生ポリペプチド鎖タンパク質翻訳装置であるリボソームから一本のアミノ酸の鎖として合成されて間もない状態を指す。近年、構造を持つ前の新生ポリペプチド鎖が細胞内で多様な生命現象を制御していることが見出されている。
*5.酸化的フォールディング :分子内または分子間ジスルフィド結合形成を伴うタンパク質のフォールディング。ジスルフィド結合はタンパク質の構造安定性や立体構造形成に重要な役割を果たす。小胞体では、主にPDIを代表とするPDIファミリータンパク質が基質のジスルフィド結合形成を触媒する。
*6.酸化ストレス:H2O2に代表される活性酸素種によって惹起されるストレス。Ero1αから産生されるH2O2は小胞体内腔からサイトゾルへ漏洩し、酸化ストレスの引き金となると考えられている。
*7.システイン残基:タンパク質を構成するアミノ酸の一つ。側鎖に硫黄原子を含んだチオール基をもち、化学反応性に富む。また、システイン残基同士でジスルフィド結合と呼ばれる共有結合を形成する。
*8.ペグマレイミドシフトアッセイ:システイン残基のチオール基に対して特異的に結合し、修飾剤として機能するペグマレイミドを用い、タンパク質のレドックス状態を観察することができる実験手法。ペグマレイミドはポリエチレングリコールを意味するペグ部位とマレイミド基に分けることができ、マレイミド基がシステイン残基のチオール基に特異的な結合能をもつ。また、ペグ部位の分子量の大きさには種類がある。したがって、ペグ部位の大きさによるが、ペグマレイミドが修飾されたタンパク質は通常の分子量よりも大きくなり、結果として、SDS-PAGE電気泳動後において分子量の差異が生じる。本記事では、還元型のタンパク質にペグマレイミドが修飾されるため、還元型は分子量が酸化型と比較して大きくなる。
論文情報
| 論文タイトル | 「The oxidative folding of nascent polypeptides provides electrons for reductive reactions in the ER」 (新生ポリペプチド鎖の酸化的フォールディングが小胞体内腔における還元反応へ電子を供給する) |
|---|---|
| 掲載誌 | Cell Reportsオンライン速報版 |
| 掲載日 | 2023年7月26日(水) |
| 著 者 | 上垣日育1, a 、徳永裕二e 、井上道雄f、高島成二g 、稲葉謙次f 、竹内恒e、潮田亮2, b, d 、永田和宏2, c, d (1 筆頭著者、2 責任著者) (所属 : a. 京都産業大学大学院生命科学研究科、b. 京都産業大学生命科学部、c. 京都産業大学、 d. 京都産業大学タンパク質動態研究所、e. 東京大学大学院薬学系研究科、 f. 東北大学多元物質科学研究所、g. 大阪大学大学院医学系研究科) |
| DOI | 10.1016/j.celrep.2023.112742 |
資料
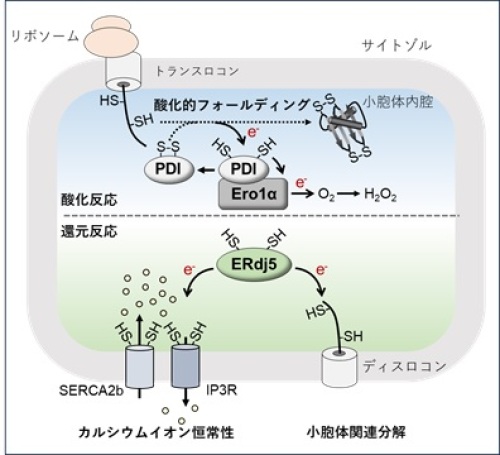
リボソームから合成された新生ポリペプチド鎖は小胞体に挿入されると、PDI-Ero1α複合体を介した酸化的フォールディングによりジスルフィド結合が形成され、成熟タンパク質へと折りたたまれる。このとき、PDIは基質から電子(e-)を奪い、Ero1αに電子を受け渡す。Ero1αは受け取った電子を分子状酸素(O2)に放出し、過酸化水素(H2O2)を産生する。一方、ERdj5は小胞体で折りたたみに失敗したタンパク質(ミスフォールドタンパク質)のジスルフィド結合を還元し、その分解経路である小胞体関連分解に貢献している。また、ERdj5は小胞体膜にあるカルシウムイオン放出チャネルIP3受容体(IP3R)やカルシウムイオン輸送体SERCA2bのジスルフィド結合を還元し、それぞれのカルシウムイオン放出または輸送活性を制限することで、小胞体のカルシウムイオン恒常性維持にも寄与する。

(A):PDIのレドックス状態はEro1α過剰発現下において、還元型から酸化型へと移行した。一方、(B):ERdj5のレドックス状態はEro1α過剰発現下において、酸化型から還元型へと移行した。これら結果から、Ero1αがPDIには酸化酵素として機能し、ERdj5には還元酵素として機能することを示した。
(IBはイムノブロットの略称であり、タグ付きのPDI、Ero1α、およびERdj5の発現をそれぞれのタグに対する抗体で検出した。)
(IBはイムノブロットの略称であり、タグ付きのPDI、Ero1α、およびERdj5の発現をそれぞれのタグに対する抗体で検出した。)
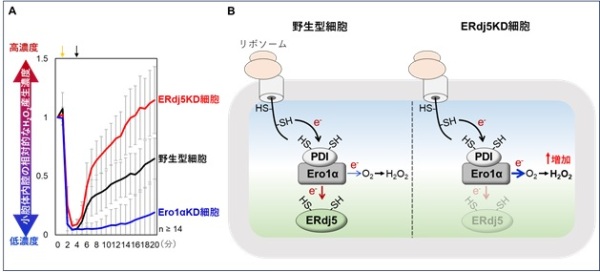
(A):小胞体内腔の相対的な過酸化水素(H2O2)濃度をライブイメージング法により測定した。観察条件は黄矢印のタイミングで小胞体内腔のH2O2濃度を還元剤により一過的に減少させた後、黒矢印のタイミングで還元剤を除き、H2O2産生量を測定した。Ero1αをノックダウン(KD)した細胞(青線)は、野生型細胞(黒線)と比較して小胞体内腔のH2O2産生が著しく減少した。これは小胞体内腔におけるH2O2の大部分がEro1αによって産生されることを示している。一方、ERdj5KD細胞(赤線)は、野生型細胞(黒線)よりもH2O2の産生量が劇的に増加した。つまり、(B):野生型細胞ではERdj5がEro1αから電子を奪うことで(e-)を奪うことで(赤矢印)、Ero1αから分子状酸素(O2)への電子伝達量が少なくなり(青矢印)、H2O2の産生が抑えられる。これに対して、ERdj5KD細胞では、ERdj5がないため、Ero1αからO2への電子伝達量が増え(青矢印)、H2O2の産生が増加する。
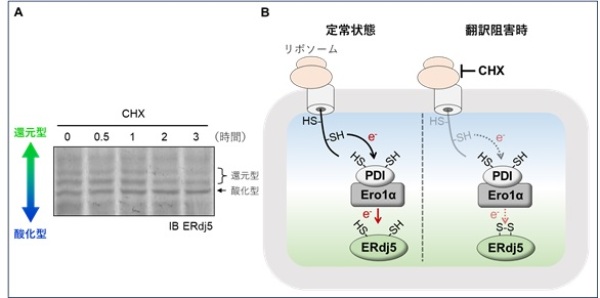
(A):リボソームの翻訳阻害剤であるシクロへキシミド(CHX)を細胞に処理し、ERdj5のレドックス状態を観察した。結果、還元型ERdj5がCHX処理時間依存的に著しく減少した。この結果から、(B):定常状態において、リボソームから合成された新生ポリペプチド鎖が、PDI-Ero1α複合体を介してERdj5へ電子(e-)を供給していることが示された。リボソームの翻訳阻害時には、小胞体に合成される新生ポリペプチド鎖が減少するため、ERdj5がe-を受け取れず、酸化型へとレドックス状態が傾く。
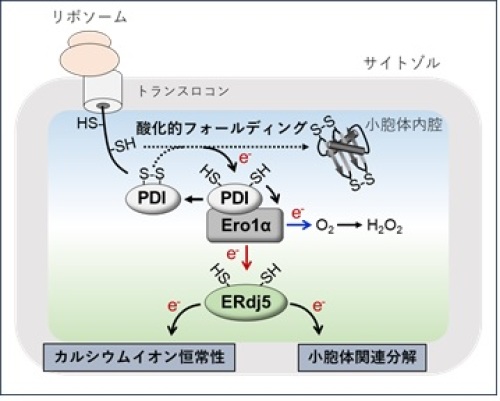
PDI-Ero1α複合体は小胞体に挿入された新生ポリペプチド鎖の酸化的フォールディングを促進し、新生ポリペプチド鎖から電子(e-)を奪う。奪った電子はEro1αを介して分子状酸素(O2)に受け渡され、過酸化水素(H2O2)の産生に消費される(青矢印)。これが従来、知られていた電子伝達経路であったが、ERdj5はEro1αと結合することで、PDI-Ero1α複合体による酸化的フォールディングから生じた電子を受け取り、還元力を獲得する(赤矢印)。
- お問い合わせ先
-
京都産業大学 広報部
〒603‐8555 京都市北区上賀茂本山
Tel.075-705-1411
kouhou-bu@star.kyoto-su.ac.jp

