カルシウムイオンチャネルIP3受容体の酸化還元による制御に関わるタンパク質を同定し、 IP3受容体が小胞体レドックスによって自律的に制御されることを解明
京都産業大学生命科学部 潮田 亮准教授らの研究グループは、記憶や学習のような脳機能、アレルギー(免疫)、筋収縮など様々な生命現象に関わるカルシウムイオンチャネル「IP3受容体」の新たな制御メカニズムを解明しました。IP3受容体は幅広い生命現象に関わるため、基礎的な分子機構の理解に留まらず、脳機能や免疫応答に関連する様々な疾患(アルツハイマー病やパーキンソン病など)メカニズムの理解、治療法開発など応用的な研究への架け橋になることが期待されます。
リリース日:2023-05-23
発表論文
「Redox states in the endoplasmic reticulum directly regulate the activity of calcium channel, inositol 1,4,5-trisphosphate receptors」
本件のポイント
IP3受容体*1 のカルシウムイオン放出活性を増加させる酸化酵素(ERp46)と、活性を下げる還元酵素(ERdj5)を発見した
IP3受容体のシステイン残基*2 が複合体形成に重要であることを発見した
IP3受容体の小胞体内腔領域の酸化還元状態のみに依存した自律的なチャネル活性制御機構を解明した
今回、見出した制御因子が、IP3受容体に起因するアレルギー疾患、神経変性疾患など様々な病気や老化に対する治療法の新たなターゲットになる可能性がある
概要
京都産業大学 永田和宏名誉教授、生命科学部潮田亮准教授、生命科学研究科大学院生の藤井唱平らの研究グループは、小胞体のカルシウムイオン(Ca2+ )チャネルIP3受容体の酸化還元状態に依存した正負両面の新たな制御メカニズムを解明しました。この制御機構は老化や神経変性*3 など様々な疾患によって生じる細胞内環境の変化とCa2+ を介したシグナル伝達*4 の異常を結びつける重要な発見であり、関連する疾患メカニズムの理解から、治療法解明に新たな知見をもたらすことが期待されます。
背景
カルシウムイオン(Ca2+ )は、細胞内の情報伝達物質として筋肉の収縮や免疫応答など様々な生命現象において重要な役割を果たしています。細胞小器官の1つである小胞体は、主要な細胞内Ca2+ ストアとして高濃度のCa2+ を保持し、サイトゾルと比較しておよそ10,000倍のCa2+ 濃度勾配を形成しています。細胞外からの刺激によって生じる細胞内のCa2+ 濃度の変動は、小胞体からの一過的なCa2+ 放出によって生み出され、下流のシグナル伝達経路のセカンドメッセンジャーとして機能しています。特にCa2+ 放出チャネルIP3受容体を介したCa2+ 放出は神経細胞、ひいては脳機能に重要であることが知られています。IP3受容体の機能が損なわれると小脳失調となり体を動かすことが困難になります。一方で、病理学的には神経変性疾患患者において過剰なIP3受容体の活性化が認められており、これによって正常なシグナル伝達がかく乱され、神経細胞が死んでしまい脳機能の低下に繋がります。このようなIP3受容体の活性変化は、細胞内環境の1つである酸化還元(レドックス)環境の変化に依存することが示唆されていました。しかし、IP3受容体のCa2+ 放出活性をどのようなレドックス酵素が制御しているのか、その分子メカニズムの詳細はわかっていませんでした。本研究では、IP3受容体の小胞体内腔領域に存在する4つシステイン残基に着目し、レドックス制御を担う因子を同定し、Ca2+ 放出活性制御の詳細な分子メカニズム解明に挑みました。
研究成果
IP3受容体の制御に関わる因子の探索のため、ゲノム編集技術CRISPR-Cas9*5 を用いて小胞体内腔の酸化還元酵素群*6 の遺伝子欠損細胞株を作製し、IP3受容体を介したCa2+ 放出活性や細胞内環境の変化を解析しました。多くの酸化還元酵素の遺伝子欠損細胞でCa2+ 放出活性の変化が観察され、最終的に直接的な制御因子として酸化酵素ERp46と還元酵素ERdj5を同定しました。ERp46はIP3受容体を酸化することによってCa2+ 放出活性を正に制御し、逆にERdj5はIP3受容体を還元することによって負に制御することを明らかにしました。また、この制御は、IP3受容体の小胞体内腔の酸化還元状態に依存しており、まったく新しいCa2+ 放出活性制御であることがわかりました。これらの研究成果から、小胞体内腔のレドックス環境の変化がこれらの酵素を介してIP3受容体を介したCa2+ シグナルに異常を引き起こす可能性が示唆されました。このことは、疾患や老化など小胞体内腔のレドックス環境の変化とCa2+ シグナルとの関係を結びつける重要な知見となります。2+ ポンプSERCA2b*7 の活性化にも寄与することを明らかにし、ERdj5の細胞内でのCa2+ 恒常性おける重要性を示してきました。本研究の成果とあわせて、ERdj5はポンプを正に制御し、チャネルを負に制御するというレシプロカルなCa2+ 制御機構を見出しました。小胞体内腔のCa2+ 濃度が低下した時に、効率よくCa2+ 濃度を回復させる合目的的なCa2+ 恒常性維持機構モデルを提唱します。
今後の展開
今回、Ca2+ チャネルIP3受容体の制御因子を2つ見出し、レドックス状態が直接的にチャネル活性を変化させることを明らかにしました。IP3受容体によるCa2+ 放出は、ヒトなどの細胞のシグナル伝達の重要なステップであり、病気や老化にも深い関わりがあります。例えば、花粉症では対症療法として抗ヒスタミン薬が用いられていますが、ヒスタミンに反応した細胞が引き起こすリアクションもIP3受容体を介したCa2+ 放出によるものです。過剰なヒスタミンによって、細胞が過剰反応をしないようにする薬剤として、レドックス制御因子が抗ヒスタミン薬以外の創薬ターゲットとなる可能性があります。アルツハイマー病やパーキンソン病といった神経変性疾患では、Ca2+ 恒常性の破綻も神経変性の一因と見られています。老化に伴って避けがたく生じる小胞体の恒常性維持機能の低下を、ERdj5の活性化によって予防できれば、健康寿命を延ばすことにつながる可能性も期待されます。
用語・事項の解説
1. IP3受容体
細胞外からのシグナルによって引き起こされる細胞内のCa2+ 濃度上昇を担う小胞体膜上のCa2+ チャネル。
2. システイン残基
タンパク質を構成するアミノ酸の一つ。側鎖に硫黄原子をもち、化学反応性に富む。また、システイン残基同士でジスルフィド結合と呼ばれる共有結合を形成する。
3. 神経変性
神経細胞が機能を失ってしまっている状態、あるいは死んでいく状態にあること。また、それによって引き起こされる脳機能の異常や疾患の総称。アルツハイマー病やパーキンソン病などが神経変性疾患に含まれる。
4. シグナル伝達
細胞内外における情報の交換のこと。また、その分子実体をまとめてシグナル伝達経路とよぶ。
5. CRISPR-Cas9
ゲノム編集技術のひとつ。遺伝子改変を容易にした革命的実験ツール。2019年にノーベル賞化学賞の受賞対象になった。
6. 小胞体内腔の酸化還元酵素群
リボソームによって合成されたポリペプチド鎖は、立体構造形成を経て機能をもつタンパク質となる。細胞外に分泌されるタンパク質などにおいては、システイン残基の酸化によって形成されるジスルフィド結合が立体構造の安定化に寄与している。このタンパク質のジスルフィド結合形成を行うタンパク質が酸化還元酵素であり、ヒトの小胞体には約20種類もの数が存在する。本研究で用いたERp46は酸化反応を主に触媒し、一方でERdj5は還元反応のみを触媒する酵素であり、約20種の酵素それぞれが少しずつ異なる特性を持つ。
7. SERCA2b
濃度勾配に逆らって能動的にCa2+ を運搬するポンプタンパク質。SERCA2bは小胞体に複数存在するポンプタンパク質のうちのひとつ。
参考図
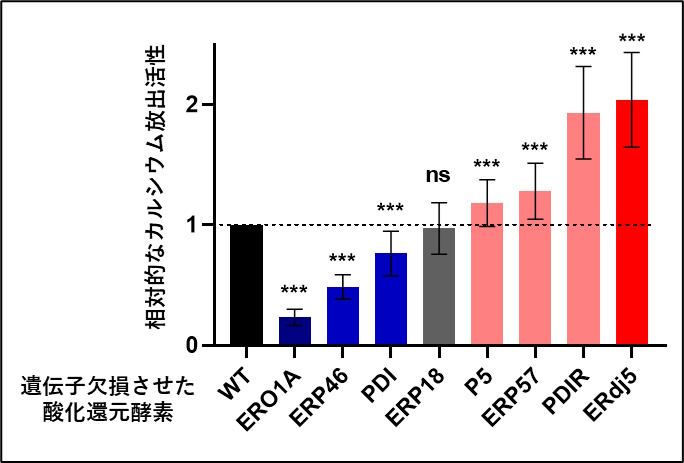
図1: IP3受容体の制御に関わる酸化還元酵素の同定
小胞体内腔の酸化還元酵素を遺伝子欠損した細胞では、さまざまにチャネル活性の変化が見られた。その中で、酸化酵素として機能するERO1、ERp46、PDIの遺伝子欠損によってカルシウム放出が低下した。また、還元酵素のとして機能するERdj5、PDIRの遺伝子欠損によってカルシウム放出が上昇したため、これらの酵素についてIP3受容体に与える影響の解析を進めた。
(***は野生型細胞WTに対して有意に差があることを示す)
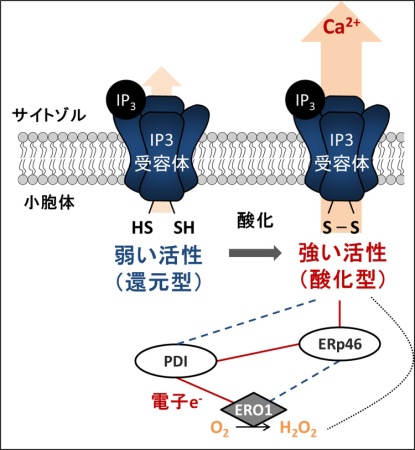
図2: 小胞体の酸化酵素によるIP3受容体の活性化
小胞体内腔の酸化酵素ERp46がIP3受容体を酸化する酵素であることがわかった。また、PDIとERO1は小胞体内で酸素(O2)へと電子伝達を行い、酸化還元酵素に酸化力を供給するネットワークを形成していることが明らかになっていた。本研究においても、この酸化力供給経路に依存して、IP3受容体の酸化による活性化が引き起こされることを示した。
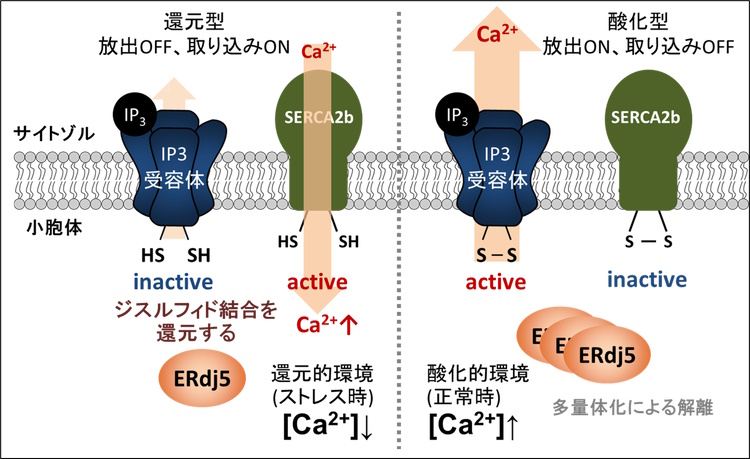
図3: ERdj5を介したカルシウム恒常性維持機構モデル
小胞体内腔のカルシウム濃度が低下したとき、小胞体のジスルフィド還元酵素ERdj5はIP3受容体とカルシウムポンプSERCA2bの両方を還元し、カルシウムの放出を抑制し、取り込みを促進するというレシプロカルな制御を行う。また、小胞体内腔のカルシウム濃度が正常なレベルまで回復したときには、ERdj5は多量体化し、チャネルとポンプから解離する。それによって、IP3受容体はシグナルに応じてカルシウムを放出することができ、一方で、カルシウムの取り込みが抑制される。小胞体内腔のカルシウム濃度に依存したERdj5による合目的的なカルシウム恒常性維持を提唱する。
論文情報
論文タイトル
「Redox states in the endoplasmic reticulum directly regulate the activity of calcium channel, inositol 1,4,5-trisphosphate receptors」
掲載誌
米国科学雑誌「米国科学アカデミー紀要’(PNAS)」(オンライン版)
掲載日
2023年5月22日(15:00)(米国東部時間)
著者
(1筆頭著者、2責任著者)(研究当時)1 、潮田亮2 、永田和宏2 (京都産業大学生命科学部、京都産業大学タンパク質動態研究所)
DOI
10.1073/pnas.2216857120
謝辞
本研究は、科学技術振興機構における戦略的創造研究推進事業JST-CREST「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術」研究領域 研究課題名「小胞体恒常性維持機構:Redox, Ca2+, タンパク質品質管理のクロストーク」(課題番号:JPMJCR13M6 研究代表者:永田 和宏)、科学研究費補助事業における学術変革領域研究(A)「新興硫黄生物学が拓く生命原理変革」研究領域 研究課題名「タンパク質品質管理を支える電子移動媒体としての超硫黄分子の役割」(課題番号:21H05268 研究代表者:潮田 亮)、科研費「基盤研究(S)(課題番号:JP18H04002 研究代表者:永田 和宏)」、科研費「基盤研究(B)(課題番号:JP22H02622 研究代表者:潮田 亮)」、科研費「基盤研究(C)(課題番号:JP18K06140 研究代表者:潮田 亮)」、日本医療研究開発機構(AMED)における革新的先端研究開発支援事業AMED-CREST「プロテオスタシスの理解と革新的医療の創出」研究領域 研究課題名「プロテオスタシスにおけるタンパク質構造形成機構の包括的解明」(課題番号:JP21GM1410008 研究代表者:田口 英樹 研究分担者:潮田 亮)および武田科学振興財団の支援により実施されました。
お問い合わせ先
内容について:京都産業大学生命科学部 潮田 亮 准教授
〒603‐8555 京都市北区上賀茂本山