脳のシナプスでアセチルコリン受容体の局在を調節する仕組みを解明神経変性疾患の発症機構の解明に新たな可能性
2023.05.08
京都産業大学総合学術研究所 浜千尋 科研費研究員らの研究グループは、実験材料にショウジョウバエを用いたアプローチから、脳のシナプスにおける情報伝達に直接関わるニコチン性アセチルコリン受容体の局在調節機構を新たに発見しました。
本成果は「the Journal of Neuroscience」(米国神経科学会誌)に掲載されました。
リリース日:2023-05-08
本件のポイント
- ニコチン性アセチルコリン受容体は、脳機能を生成・調節するシナプスでの情報伝達に直接関わるタンパク質であるが、解析の難しさなどから、シナプス膜上の局在制御機構に関する研究は進んでこなかった。
- ミ本研究では、本研究グループが25年以上前に同定した中枢コリン作動性シナプスの間隙に局在する分泌性タンパク質Higと相互作用するタンパク質の同定を個体を対象とした遺伝学を駆使して進め、ニコチン性アセチルコリン受容体の局在制御においてHigとアセチルコリン受容体サブユニットD5が相互作用しながら重要な働きをすることを発見した。
- 今後、Dα5タンパク質よる受容体の局在調節機構および、その機構とシナプス可塑性や脳機能との関連を解明していくことは、コリン作動性シナプスを通した脳機能の調節機構の理解につながり、また神経変性疾患の発症機構の解明に新たな道を示す可能性がある。
| タイトル | 「Control of synaptic levels of nicotinic acetylcholine receptor by the sequestering subunit Dα5 and secreted scaffold protein Hig」(ニコチン性アセチルコリン受容体のシナプス局在量は、引き込みサブユニットDα5と分泌性足場タンパク質Higにより調節される) |
|---|---|
| 掲載誌 | 米国神経科学会誌「the Journal of Neuroscience」 |
| 掲載日 | 2023年4月28日(金) |
| 著者 |
中山実1(京都産業大学、東邦大学)、浜千尋2、西村勇飛、北市三和(京都産業大学)
西村 理、工樂樹洋(理化学研究所曽根雅紀(東邦大学) (1筆頭著者、2責任著者)(所属機関は研究当時) |
| DOI | 10.1523/JNEUROSCI.2243-21.2023 |
脳のシナプスでアセチルコリン受容体の局在を調節する仕組みを解明
研究体制
京都産業大学、東邦大学、理化学研究所の研究グループによる共同研究
発表論文
Control of synaptic levels of nicotinic acetylcholine receptor by the sequestering subunit Da5 and secreted scaffold protein Hig
(ニコチン性アセチルコリン受容体のシナプス局在量は、引き込みサブユニットDa5と分泌性足場タンパク質Higにより調節される)
本研究成果は、米国神経科学会誌「the Journal of Neuroscience」に掲載。
著者
中山 実(筆頭著者:京都産業大学、東邦大学理学部博士研究員)
西村 理(理化学研究所)
西村勇飛、北市三和(京都産業大学)
工樂樹洋(理化学研究所:現、国立遺伝学研究所)
曽根雅紀(東邦大学)
浜 千尋(責任著者:京都産業大学)
西村 理(理化学研究所)
西村勇飛、北市三和(京都産業大学)
工樂樹洋(理化学研究所:現、国立遺伝学研究所)
曽根雅紀(東邦大学)
浜 千尋(責任著者:京都産業大学)
本論文のポイント
どのような成果を出したのか
脳の機能はシナプスを介した神経細胞間の情報伝達によって生じます。本研究グループは、その情報伝達に直接関わるニコチン性アセチルコリン受容体が、シナプスの膜上でどのように維持され、またその量的調節がなされるのかという基本的な問題に対して、ショウジョウバエを実験材料に用いてアプローチし、その調節機構を発見しました。
何が新しいのか
ニコチン性アセチルコリン受容体は、神経細胞間の情報伝達装置であるシナプスで機能する重要なタンパク質であるために、その構造や役割については非常に多くの研究が行われてきました。しかし、この受容体がシナプスの膜にどのようにして維持され、その量的調節が行われるのかは、ほとんど理解されていませんでしたが、本研究はその調節機構に新たな知見をもたらしました。具体的には、サブユニットタンパク質が5個集まってできるアセチルコリン受容体が、Da5とよばれるサブユニットタンパク質を持つと、そのDa5がシナプス膜上の受容体量を減少させる作用を示すことがわかりました。一方で、シナプス間隙に存在するHigタンパク質が、細胞外からDa5サブユニットと相互作用すると、Da5によるアセチルコリン受容体の局在抑制を妨げ、受容体の量を維持させることが明らかとなったのです。もう一つ面白い点は、Higタンパク質が欠損してしまうと、その個体のほとんどは死んでしまうのですが、少なくともその原因の一つがDa5の作用によるものであることもわかりました。つまり、Da5は、本来アセチルコリン受容体のサブユニットでイオンチャネルの構成因子として生理的に機能しますが、シナプス間隙にあるHigタンパク質と相互作用できなくなると致死因子になるという二面性を持つのです。
社会的意義/将来の展望
まず、神経科学の分野に残された非常に基本的で未解明の問題に対して新たな知見をもたらすことができたことに意義があります。そして、問題が基本的であればあるほど、その波及効果は大きいはずです。アセチルコリンを神経伝達物質として用いるコリン作動性シナプスは、いくつかの神経変性疾患で異常を示すことが知られており、アルツハイマー病もその一つです。本研究で示された、アセチルコリン受容体の特定のサブユニットタンパク質とシナプス間隙タンパク質との相互作用によりシナプス機能が維持され、その作用が欠損するとシナプス機能が破綻し異常を示す、という視点は、神経変性疾患の発症機構の解明に新たな道を示す可能性があります。
研究の概要
シナプスの「すきま」に存在する分泌性タンパク質であるHigをコードする遺伝子が欠損したショウジョウバエの個体(hig変異体)は殆ど致死となり、生き残った個体も低い活動性を示します。このHigタンパク質と相互作用するタンパク質を同定する目的で、hig変異をもつ染色体DNAに第二の変異をランダムに導入し、hig変異体の致死性ないし低活動性を回復させるサプレッサー変異の分離を試みました。その結果、ニコチン性アセチルコリン受容体のサブユニットの一つであるDa5に変異が生じて機能を失うと、hig変異体の表現型が正常に近づくことがわかりました。さらに、hig変異体では、Da5およびDa6サブユニットのシナプスにおける局在量が野生型と比べて減少しますが、hig Da5二重変異体では、Da6およびDa7サブユニットの量は野生型以上となり、またDa5単独変異体でも野生型以上となりました。すなわち、Da5サブユニットタンパク質にはアセチルコリン受容体の局在量を減少させる作用があることが判明しました。また、Da5、Da6、Da7サブユニットを対象とした実験において、Higタンパク質はDa5とDa7の両方と正の相互作用を示しましたが、Da6とは示しませんでした。また、hig変異体においてDa5を過剰発現させると、Da5はシナプスの内部に異常な分布をしましたが、Da6とDa7を過剰発現させてもそのような異常を示しませんでした。さらに、Higと相互作用できない変異型のDa5は、それを過剰発現させるとHig存在下でも異常な分布を示し、かつその個体の多くは致死となりました。以上のことから、Da5はエンドサイトーシスを誘導してアセチルコリン受容体のシナプス局在量を抑制する一方で、シナプス間隙に存在するHigタンパク質がその作用を抑えてアセチルコリン受容体の局在量を維持する、という制御機構モデルを提出しました。
研究の背景
ニコチン性アセチルコリン受容体はシナプスでの神経伝達において重要なタンパク質であるのにもかかわらず、何故今までシナプス膜上の局在制御機構に関する研究が進んでいなかったのでしょうか。その原因として、第一にニコチン性アセチルコリン受容体は5個のサブユニットから構成されますが、そのサブユニットの種類が多いために解析がしづらい、第二に培養細胞では細胞表面に局在させることが難しい、第三に中枢神経系で細胞外タンパク質との相互作用についての知見が得られていなかった、などが挙げられます。
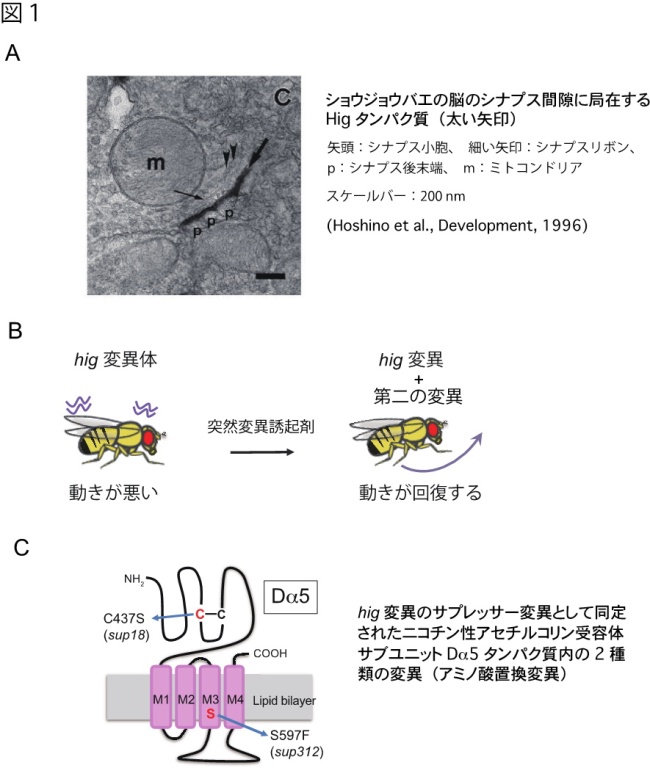
本研究グループは、今から25年以上も前になりますが、ショウジョウバエの遺伝学的解析から中枢シナプス間隙に局在するHigタンパク質を同定しました(図1A)。おそらくHigは、動物種を問わず、中枢シナプス間隙に局在することが示された初めての分泌性タンパク質です。その後、Higはコリン作動性シナプスのシナプス間隙に特異的に局在することがわかりましたが、今でも、中枢コリン作動性シナプスの間隙に局在する分泌性タンパク質は、Higとやはりわれわれが同定したHaspしか知られていません。今回の研究では、Higと相互作用するタンパク質の同定を、個体を対象とした遺伝学を駆使して進めており、そのことがニコチン性アセチルコリン受容体の局在制御機構の解明につながったと考えています。
本研究グループは、今から25年以上も前になりますが、ショウジョウバエの遺伝学的解析から中枢シナプス間隙に局在するHigタンパク質を同定しました(図1A)。おそらくHigは、動物種を問わず、中枢シナプス間隙に局在することが示された初めての分泌性タンパク質です。その後、Higはコリン作動性シナプスのシナプス間隙に特異的に局在することがわかりましたが、今でも、中枢コリン作動性シナプスの間隙に局在する分泌性タンパク質は、Higとやはりわれわれが同定したHaspしか知られていません。今回の研究では、Higと相互作用するタンパク質の同定を、個体を対象とした遺伝学を駆使して進めており、そのことがニコチン性アセチルコリン受容体の局在制御機構の解明につながったと考えています。
研究成果
まず、ショウジョウバエのシナプス間隙に存在するHigタンパク質と相互作用するタンパク質を同定する目的で、hig遺伝子の突然変異体の表現型を回復させるサプレッサー変異の分離と同定を行いました。hig変異体の多くは成長過程で死んでしまい、成虫になってもほとんど動かなくなりますが、hig変異をもつ染色体に第二の変異をランダムに導入することによって、成虫になっても動く変異体を分離することに成功しました(図1B)。そして、その染色体のすべてのDNA配列を決定することにより、その変異がニコチン性アセチルコリン受容体のサブユニットであるDa5遺伝子に生じていることが明らかとなりました(図1C)。この結果は、HigとDa5が相互作用している、あるいは同じシグナル経路で働くことを示唆しています。
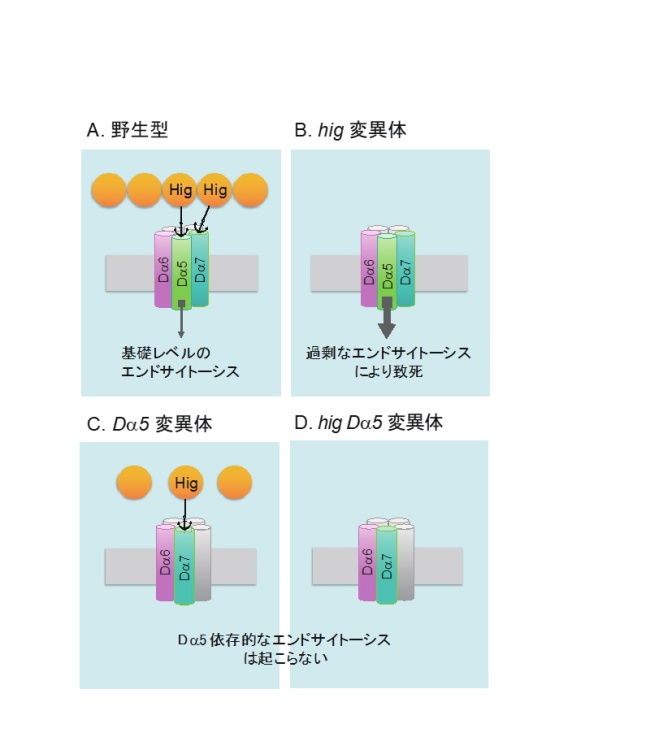
上記のサプレッサー変異の同定から始まった複数の実験結果をまとめて、以下のような「ニコチン性アセチルコリン受容体のシナプス後膜上における局在制御機構」についてのモデルを提出しました(図2参照)。
A. 野生型では、Da5およびDa7をシナプス膜上に留めるHigがシナプス間隙に存在しており、Da5に依存した基礎レベルのエンドサイトーシスによりニコチン性アセチルコリン受容体のシナプス膜上における局在量は一定のレベルに制御されている。
B. hig変異体では、Da5をシナプス膜上に留めるHigが存在しないため、Da5は過剰にエンドサイトーシスを引き起こし、アセチルコリン受容体の膜上の局在量は減少する。そのことが致死の原因の一つとなる。ただし、エンドサイトーシスは広範囲に起こる可能性があり、Da5を含まない受容体でも共にエンドサイトーシスを受けるかもしれない。
C, D. Da5変異体およびhig Da5二重変異体では、Da5が存在しないためにDa5依存的なエンドサイトーシスは起こらない。その結果、アセチルコリン受容体の局在量は野生型に比べて増加する。
A. 野生型では、Da5およびDa7をシナプス膜上に留めるHigがシナプス間隙に存在しており、Da5に依存した基礎レベルのエンドサイトーシスによりニコチン性アセチルコリン受容体のシナプス膜上における局在量は一定のレベルに制御されている。
B. hig変異体では、Da5をシナプス膜上に留めるHigが存在しないため、Da5は過剰にエンドサイトーシスを引き起こし、アセチルコリン受容体の膜上の局在量は減少する。そのことが致死の原因の一つとなる。ただし、エンドサイトーシスは広範囲に起こる可能性があり、Da5を含まない受容体でも共にエンドサイトーシスを受けるかもしれない。
C, D. Da5変異体およびhig Da5二重変異体では、Da5が存在しないためにDa5依存的なエンドサイトーシスは起こらない。その結果、アセチルコリン受容体の局在量は野生型に比べて増加する。
図2
今後の展開
中枢神経系におけるニコチン性アセチルコリン受容体の局在制御機構の解明をさらに進めるためには、その調節において重要な働きをすることが本研究で示されたDa5タンパク質と結合するタンパク質を同定することが必要です。また、Da5による受容体の局在調節機構とシナプス可塑性および脳機能との関連を解明していくことは、コリン作動性シナプスを通した脳機能の調節機構と神経疾患の理解につながります。
研究助成
本研究はJSPS科研費JP15K06721、JP18K06471(以上、浜)、JP15K21489(中山)の助成を受けたものです。
用語・事項の解説
- シナプス 神経細胞と神経細胞の間で情報を伝えるために特殊化した構造。片方の神経細胞がつくるシナプス前終末からシナプス小胞内の神経伝達物質が放出されると、神経伝達物質はシナプス構造の隙間(シナプス間隙)を通って、別の神経細胞がつくるシナプス後終末の表面に存在する受容体によって受け取られる。このことにより神経細胞間での情報伝達(シナプス伝達)が行われる。
- 神経伝達物質 神経伝達物質には多くの種類があり、アセチルコリン、グルタミン酸、GABA、セロトニン、ドーパミンなどが知られている。神経系におけるそれぞれの作用は、特異的に結合する受容体の性質によって決まる。
- ニコチン性アセチルコリン受容体 アセチルコリンが結合するとチャネルが開いて陽イオンを通すイオンチャネル型の受容体。サブユニットが5個集まってつくられる。サブユニットの種類は多くあり、ショウジョウバエで10種、脊椎動物では十数種ある。
- お問い合わせ先
-
京都産業大学 広報部
〒603‐8555 京都市北区上賀茂本山
Tel.075-705-1411
kouhou-bu@star.kyoto-su.ac.jp
