細菌の薬剤耐性化の原因となる新たな因子とその発現メカニズムの発見
2023.03.27
薬剤耐性菌は私たち人類にとって大きな脅威のひとつであり、これを制御するためには、薬剤耐性機構の理解が必要です。ARE-ABCFは、抗菌薬に対する耐性の発現に関係するタンパク質で、多くの細菌が有しています。しかし、それぞれの生物で見いだされるARE-ABCF遺伝子配列は多様であり、その多様性と薬剤耐性の関連については十分に解明されていませんでした。
ディフィシル感染症(Clostridioides difficile infection: CDI)は、抗菌薬使用などによりディフィシル菌が増殖して常在腸内細菌叢が撹乱され、下痢などを発症する感染症です。本研究グループは、ディフィシル菌が持つARE-ABCF遺伝子(cplR)が、リンコサミド系とプレウロムチリン系の抗菌薬に対する薬剤耐性を媒介することを明らかにしました。また、ディフィシル菌がcplRと同時に、可動性因子であるトランスポゾン上にコードされる薬剤耐性遺伝子ermBを持つことによって、相乗的にリンコサミド系薬剤に対する耐性が上昇することを発見しました。さらにcplR遺伝子の発現が、抗菌薬に応答して誘導されるメカニズムを明らかにしました。CDIは、ディフィシル菌が高い抗菌薬耐性を持つために発生するもので、多くの場合、抗菌薬の投与によって発生し、慢性感染や院内感染の原因となります。特にリンコサミド系抗菌薬の投与によりディフィシル感染症が引き起こされることが示されており、ARE-ABCFおよびその遺伝子発現制御機構を標的とした予防・治療薬の開発が期待されます。
ディフィシル感染症(Clostridioides difficile infection: CDI)は、抗菌薬使用などによりディフィシル菌が増殖して常在腸内細菌叢が撹乱され、下痢などを発症する感染症です。本研究グループは、ディフィシル菌が持つARE-ABCF遺伝子(cplR)が、リンコサミド系とプレウロムチリン系の抗菌薬に対する薬剤耐性を媒介することを明らかにしました。また、ディフィシル菌がcplRと同時に、可動性因子であるトランスポゾン上にコードされる薬剤耐性遺伝子ermBを持つことによって、相乗的にリンコサミド系薬剤に対する耐性が上昇することを発見しました。さらにcplR遺伝子の発現が、抗菌薬に応答して誘導されるメカニズムを明らかにしました。CDIは、ディフィシル菌が高い抗菌薬耐性を持つために発生するもので、多くの場合、抗菌薬の投与によって発生し、慢性感染や院内感染の原因となります。特にリンコサミド系抗菌薬の投与によりディフィシル感染症が引き起こされることが示されており、ARE-ABCFおよびその遺伝子発現制御機構を標的とした予防・治療薬の開発が期待されます。
研究代表者
筑波大学医学医療系
尾花 望 助教
京都産業大学生命科学部
高田 啓 研究員
リリース日:2023-03-27
背景
抗菌薬の効かない薬剤耐性菌の出現は、世界中で深刻な問題となっています。何も対策を講じなかった場合、2050年には薬剤耐性菌が原因で年間1000万人もの人が亡くなるとの試算があります(O’Neill, 2014)。ARE-ABCF(ATP-binding cassette (ABC)-F protein subfamily)は、幅広い抗菌薬に対する耐性(ARE(antibiotic resistance))に関係するタンパク質で、多くの細菌が有しており、院内感染の原因として知られています。近年のクライオ電子顕微鏡注1)による生体分子の立体構造解析法の発達により、新しい作用機序によって抗菌薬に対する耐性を付与するタンパク質であることが分かってきており、薬剤耐性菌の問題が顕在化した2010年頃より、その研究が勢力的に進められています。一部の抗菌薬はタンパク質の合成(翻訳)に必要なリボソーム注2)に結合することで細菌の生育を抑制しますが、ARE-ABCFはリボソームに結合して、活性中心を標的とした抗菌薬をリボソームより解離させ、その効果を無効化させます。しかしながら、ARE-ABCF遺伝子は幅広い細菌種に保存されていることは知られているものの、生物ごとの遺伝子配列はさまざまで、その多様性は十分に解明されていませんでした。
今回着目したディフィシル感染症(Clostridioides difficile infection: CDI)は、抗菌薬の投与によりディフィシル菌が増殖することで生じる常在腸内細菌叢の乱れが原因で発症します。ディフィシル菌は高い抗菌薬耐性を有することから、抗菌薬投与から生き残ることができ、ディフィシル菌が高い耐性を有するリンコサミド系抗菌薬注3)であるクリンダマイシンの投与は、CDIのリスク因子として報告されています。また、CDIは再発を繰り返す場合があり、院内感染や慢性感染を引き起こし、生命を脅かす可能性もあります。そこで、本研究では、分子微生物学、生化学、構造生物学、バイオインフォマティクス注4)といったさまざまな分野の専門家との国際共同研究によって、ディフィシル菌のARE-ABCF遺伝子を発見し、その機能を明らかにしました。
今回着目したディフィシル感染症(Clostridioides difficile infection: CDI)は、抗菌薬の投与によりディフィシル菌が増殖することで生じる常在腸内細菌叢の乱れが原因で発症します。ディフィシル菌は高い抗菌薬耐性を有することから、抗菌薬投与から生き残ることができ、ディフィシル菌が高い耐性を有するリンコサミド系抗菌薬注3)であるクリンダマイシンの投与は、CDIのリスク因子として報告されています。また、CDIは再発を繰り返す場合があり、院内感染や慢性感染を引き起こし、生命を脅かす可能性もあります。そこで、本研究では、分子微生物学、生化学、構造生物学、バイオインフォマティクス注4)といったさまざまな分野の専門家との国際共同研究によって、ディフィシル菌のARE-ABCF遺伝子を発見し、その機能を明らかにしました。
研究方法と成果
本研究チームは、ゲノム情報を駆使したバイオインフォマティクスによって、ARE-ABCF遺伝子がディフィシル菌を含むクロストリジア綱の細菌(腸内常在細菌)の染色体に幅広く保存されていることを明らかにしました(図1)。ディフィシル菌が有するARE-ABCF遺伝子には、リンコサミド系とプレウロムチリン系の抗菌薬注3)に対する耐性を付与する役割があることを見いだし、この遺伝子をcplR (Clostridial pleuromutilin and lincosamide resistance)と命名しました。さらに、リンコサミド系抗菌薬に対しては、ディフィシル菌が、cplRと、可動性因子であるトランスポゾン注5)上にコードされる抗菌薬耐性遺伝子ermBを同時に持つことによって、相乗的に耐性が上昇することを発見しました。また、ディフィシル菌の近縁種である、食中毒細菌ウェルシュ菌(Clostridium perfringens)やガス壊疽(えそ)菌スポロゲネス菌(Clostridium sporogenes)でもcplRは保存されており、両細菌においても、cplRはリンコサミド系およびプレウロムリチン系抗菌薬への耐性を与えることを明らかにしました。cplRはボツリヌス菌などの高病原性のクロストリジア綱の細菌でも保存されており、幅広いクロストリジア綱の細菌の薬剤耐性に関係すると考えられます。
さらに、ディフィシル菌のcplR遺伝子の発現は、抗菌薬に応答して誘導されることが分かりました。cplR mRNA上にはCplRタンパク質をコードする領域(オープンリーディングフレーム:ORF)だけではなくuORFと呼ばれる小さなペプチドをコードする領域が存在しています。抗菌薬がリボソームに結合して、uORFの翻訳が阻害されると、cplR mRNAの構造が変化し、抗菌薬に応答したCplRの翻訳をもたらすことを明らかにしました。このことは、cplRの転写伸長と翻訳を促進する新規の遺伝子発現制御機構の存在を意味しています(図2)。cplRはこれまで見過ごされてきた薬剤耐性遺伝子であり、クロストリジア綱細菌のゲノムにcplRが拡散すると、幅広い抗菌薬に対する耐性が付与される危険性があることから、cplRは、薬剤耐性を伝播させないための鍵となる可能性があります。
また、放線菌鋼に属する、放線菌Saccharothrix mutabilis subsp. capreolus や土壌性細菌Neobacillus vireti(N. vireti)のARE-ABCFを新たに同定しました(図1)。放線菌鋼におけるARE-ABCFは、抗菌薬に対して非常に狭い耐性スペクトラムしかなく、自身が二次代謝によって生産する抗菌性の生理活性物質に対する自己防御に関係していることが示されました。また、クライオ電子顕微鏡法を用いて、N. vireti 由来のARE-ABCFであるタンパク質VmlR2とリボソームとの複合体構造を解析したところ、VmlR2はリボソームに結合し、リボソームの抗菌薬結合部位の構造変化を引き起こすことによって、抗菌薬を解離させることが示唆されました。この結果は、これまでに提唱されているARE-ABCFによる薬剤耐性メカニズムのモデルと一致しており、今回同定したARE-ABCFでも同様のメカニズムで抗菌薬を無効化していると考えられます。
さらに、ディフィシル菌のcplR遺伝子の発現は、抗菌薬に応答して誘導されることが分かりました。cplR mRNA上にはCplRタンパク質をコードする領域(オープンリーディングフレーム:ORF)だけではなくuORFと呼ばれる小さなペプチドをコードする領域が存在しています。抗菌薬がリボソームに結合して、uORFの翻訳が阻害されると、cplR mRNAの構造が変化し、抗菌薬に応答したCplRの翻訳をもたらすことを明らかにしました。このことは、cplRの転写伸長と翻訳を促進する新規の遺伝子発現制御機構の存在を意味しています(図2)。cplRはこれまで見過ごされてきた薬剤耐性遺伝子であり、クロストリジア綱細菌のゲノムにcplRが拡散すると、幅広い抗菌薬に対する耐性が付与される危険性があることから、cplRは、薬剤耐性を伝播させないための鍵となる可能性があります。
また、放線菌鋼に属する、放線菌Saccharothrix mutabilis subsp. capreolus や土壌性細菌Neobacillus vireti(N. vireti)のARE-ABCFを新たに同定しました(図1)。放線菌鋼におけるARE-ABCFは、抗菌薬に対して非常に狭い耐性スペクトラムしかなく、自身が二次代謝によって生産する抗菌性の生理活性物質に対する自己防御に関係していることが示されました。また、クライオ電子顕微鏡法を用いて、N. vireti 由来のARE-ABCFであるタンパク質VmlR2とリボソームとの複合体構造を解析したところ、VmlR2はリボソームに結合し、リボソームの抗菌薬結合部位の構造変化を引き起こすことによって、抗菌薬を解離させることが示唆されました。この結果は、これまでに提唱されているARE-ABCFによる薬剤耐性メカニズムのモデルと一致しており、今回同定したARE-ABCFでも同様のメカニズムで抗菌薬を無効化していると考えられます。
今後の展開
本研究では、ARE-ABCFであるcplR遺伝子がディフィシル菌の抗菌薬耐性を上昇させること、また、抗菌薬に応答してcplR遺伝子の発現が調節されているメカニズムを明らかにしました。これらの知見は、CDIの新しい治療法の開発への応用が期待されます。
今後、さらにさまざまな細菌におけるARE-ABCFの保存性や機能が明らかになることによって、薬剤耐性機構の理解やその伝播の阻止に向けた基盤的知見が得られると考えられます。また、多くの薬剤耐性遺伝子は可動性因子にコードされている一方で、今回発見したARE-ABCF遺伝子は染色体上にコードされていました。このことは、ARE-ABCFがゲノムの持ち主である細菌の生態や進化と密接に関係していることを示唆しています。リボソームに結合して機能を発揮するARE-ABCFの多様性に関する基礎的研究は、生命に必須な装置であるリボソームの機能と多様性の理解につながる可能性があります。
今後、さらにさまざまな細菌におけるARE-ABCFの保存性や機能が明らかになることによって、薬剤耐性機構の理解やその伝播の阻止に向けた基盤的知見が得られると考えられます。また、多くの薬剤耐性遺伝子は可動性因子にコードされている一方で、今回発見したARE-ABCF遺伝子は染色体上にコードされていました。このことは、ARE-ABCFがゲノムの持ち主である細菌の生態や進化と密接に関係していることを示唆しています。リボソームに結合して機能を発揮するARE-ABCFの多様性に関する基礎的研究は、生命に必須な装置であるリボソームの機能と多様性の理解につながる可能性があります。
参考図
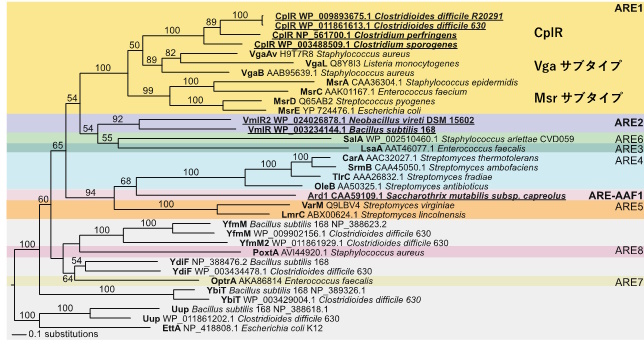
CplRはARE1サブファミリーに属する一方、ARE1サブファミリーに属する既知のARE-ABCFタンパク質であるVga、Msrサブタイプとは異なる分岐群に属する。Saccharothrix mutabilis subsp. capreolus 由来のARE-ABCFであるArd1は、放線菌目(Streptomyces)が持つAREサブファミリー(ARE4)とともに独立した分岐群に属しており、放線菌目が持つARE-ABCF(ARE4およびARE-AAF1サブファミリー) は、自身が産生する抗菌物質に対する防御に重要と考えられる。
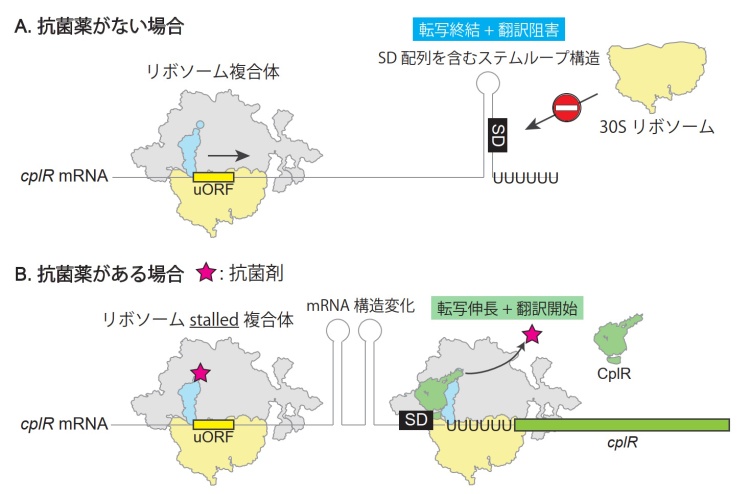
抗菌薬がない場合は、cplR mRNA中にcplR SD配列を含むステムループ構造注6)が形成され、転写終結構造として機能する。cplR mRNAの転写伸長が途中で止まり、さらにcplRの翻訳は阻害されている。抗菌薬がある場合には、上流のuORFの翻訳が停止することにより、mRNAの二次構造が変化する。これによってSD配列注7)を含むステムループ構造が解消され、転写の伸長と翻訳の開始が促進される。
用語・事項の解説
注1)クライオ電子顕微鏡
透過電子顕微鏡の一種で、試料を低温下で観察する。タンパク質などの生体分子の立体構造を高分解能で決定することができる。
注2)リボソーム
すべての細胞が持っているタンパク質合成装置。メッセンジャーRNA(mRNA)情報に基づきタンパク質を合成(翻訳)する。
注3)リンコサミド系およびプレウロムチリン系抗菌薬
リボソームを標的とする抗菌薬のグループ。これらの抗菌薬はリボソームに結合し、タンパク質合成(翻訳)を阻害することによって細菌の生育を抑制する。
注4)バイオインフォマティクス
バイオ(生物学)とインフォマティクス(情報学)が融合した分野。大量のゲノム配列などの情報を、計算機を用いて情報学的に解析する手法。
注5)トランスポゾン
ゲノムDNA上の位置を転移できる塩基配列のこと。動く遺伝子とも呼ばれる。
注6) ステムループ構造
一本鎖のRNAに見られる二次構造で、部分的な塩基対合による二重らせん(ステム:幹)構造と、対合していないループ領域が存在する。
注7) SD配列
mRNA上に存在するリボソームが結合する配列。リボソームがSD配列に結合することによってタンパク質合成(翻訳)が開始する。SD配列がステムループ構造のステムに含まれた場合、リボソームの結合が阻害される。
研究資金
本研究は、JST戦略的創造研究推進事業ACT-X(JPMJAX21BC)、JST戦略的創造研究推進事業ERATO(JPMJER1502)、科研費の研究プロジェクトの一環として実施されました。
論文情報
| タイトル | Genome-encoded ABCF factors implicated in intrinsic antibiotic resistance in Gram-positive bacteria: VmlR2, Ard1 and CplR (グラム陽性菌の内在性抗菌薬耐性に関与するゲノムにコードされたABCF因子、VmlR2、Ard1およびCplR) |
|---|---|
| 著者 | Nozomu Obana, Hiraku Takada, Caillan Crowe-McAuliffe, Mizuki Iwamoto, Artyom A. Egorov, Kelvin J.Y. Wu, Victoriia Murina, Helge Paternoga, Ben I.C. Tresco, Nobuhiko Nomura, Andrew G. Myers, Gemma C. Atkinson, Daniel N. Wilson, Vasili Hauryliuk. |
| 掲載紙 | Nucleic Acid Research |
| 掲載日 | 2023年3月23日 |
| DOI | 10.1093/nar/gkad193 |
- お問い合わせ先
-
京都産業大学 広報部
〒603‐8555 京都市北区上賀茂本山
Tel.075-705-1411
kouhou-bu@star.kyoto-su.ac.jp
