院内感染を起こすことで注意が喚起されているディフィシル菌の二成分毒素の複合体構造を解明:タンパク質膜透過の最初の動的な様子を明らかに
2022.11.02
京都産業大学生命科学部 津下 英明教授の研究グループ(山田 等仁(D3)、吉田 徹助教(現日本女子大学))は、大阪大学蛋白質研究所蛋白質結晶学研究室の川本 晃大助教、同研究所電子線構造生物学研究室加藤 貴之教授および堀場製作所 佐藤 優穂との共同研究で、ディフィシル菌の二成分毒素:CDTのタンパク質膜透過を担う装置(CDTb)とその基質タンパク(CDTa)の複合体構造を解明しました。
その結果、「CDTaが膜孔CDTbに結合し、N末端先端から解ける」という、タンパク質透過機構の最初の動的な様子が明らかになりました。
リリース日:2022-11-02
本件のポイント
- ディフィシル菌の二成分毒素であるCDTa (細胞骨格に影響を与える毒素)とCDTb膜孔(CDTaを解いて膜透過させる装置)の複合体の構造を解明しました。
- CDTaがCDTb膜孔に結合し、その後CDTaのN末端が解ける連続した様子を明らかにしました。
- この構造は、CDTb膜孔とCDTaの結合を阻害する薬剤の設計の基盤となります。
概要
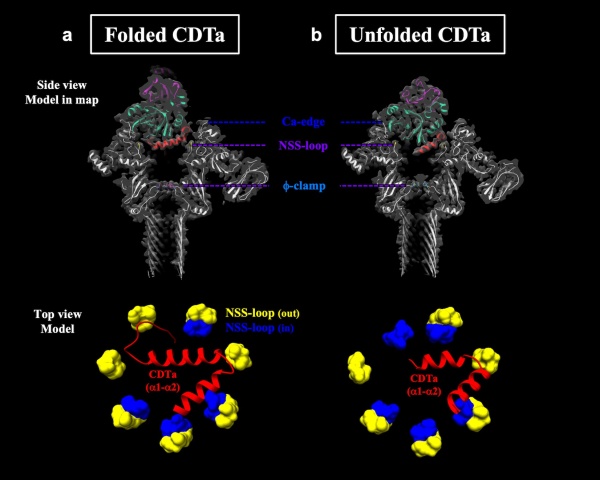
ここから3D variability analysis (3DVA) によるクラス分けを行ったところ、この複合体は単一な構造ではなく、CDTaのN末端の構造が異なる複数の状態が混在したものであることがわかりました。この結果をもとに、さらに2つの複合体構造(Folded CDTaとUnfolded CDTa) を決定することに成功しました (図3)。
https://static-content.springer.com/esm/art%3A10.1038%2Fs41467-022-33888-4/MediaObjects/41467_2022_33888_MOESM3_ESM.mp4
背景
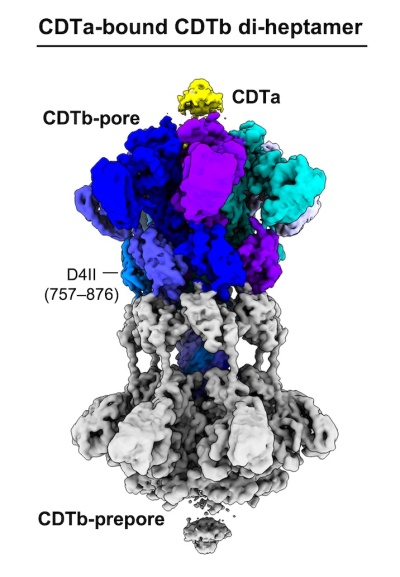
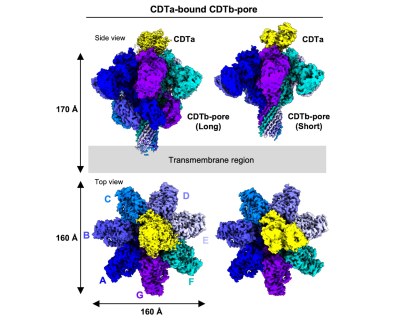
すでに、この二成分毒素複合体の構造は米国の2つのグループでクライオ電子顕微鏡の構造が解析されていましたが、ダイヘプタマー(7量体x2)の構造であることが報告されていました。一方、我々は、ウェルシュ菌タイプEが産生する二成分毒素であるイオタ毒素の複合体の構造、Iaが結合したIb膜孔の構造解析から、生理的な働きをすると考えられるヘプタマーの膜孔構造を決定しています(NSMB, 2020 27(3):288-296)。ダイヘプタマーの構造は、膜孔として機能しないアーティファクトと考えられました。そこで、Ib膜孔で用いたのと同じ界面活性剤LMNGを用いて、今回のCDTaとCDTbの二成分毒素のサンプル調整を行いました。この結果、クライオ電子顕微鏡データの測定と解析より、CDTaが結合した、CDTb膜孔ヘプタマーの構造を明らかにすることに成功しました(図2)。この解析により、初めて「CDTaがどのようにCDTb膜孔に結合するか」という詳細な情報が得られました。面白いことに、同じサンプル中にはCDTaが結合した、CDTbのダイヘプタマー(報告されたのと同じ)も存在していました (図4)。しかし、残念ながら、このダイヘプタマー構造では、CDTaの結合は平均化して見えてきません。
CDTaが結合した、CDTb膜孔ヘプタマーの構造は、Iaが結合した、Ib膜孔ヘプタマーの構造とほぼ同じでした。この特徴は、その結合により、A成分のN末端αヘリックスがアンフォールドして、残りのαヘリックスが傾く。このことによりアンフォールド鎖はB成分の膜孔の最狭窄部位であるφクランプに向かっています。この2つの構造から、二成分毒素で共通したアンフォールドの機構がわかってきました。ただし、今回のCDTb膜孔の解析では、概要に記述したようにCDTaが結合してから、その先端がアンフォールドするまでの動的な様子が、詳細にわかってきたわけです。これは膜透過機構の理解の上で重要なマイルストンとなる知見です。
今後の展望
語句説明
タンパク質は20種類のアミノ酸からなる1本の紐ですが、これが規則的にαヘリックス、βシートと呼ばれる二次構造を取り、さらに折れ畳んで立体的な三次構造を形成することで初めて機能します。そのため、通常一度折れ畳んだ(フォールドした)タンパク質は構造を失って、機能を持たない1本の紐にもどる(アンフォールドする)必要はありません。しかし、二成分毒素の膜孔装置は、タンパク質毒素をアンフォールドさせ、さらに膜透過をさせてホストの細胞内に輸送する機能を持っています。
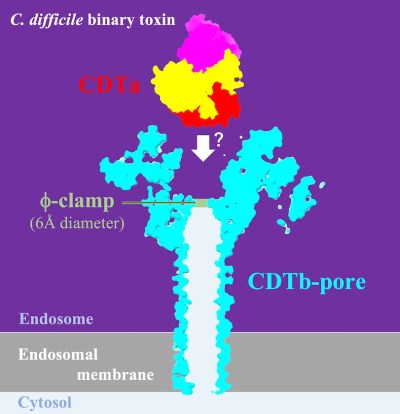
φクランプ
酵素成分の透過経路を形成する膜孔の狭窄部位の1つである (図1)。φクランプは膜孔の中央に向いた7つのフェニルアラニンによって形成され、直径はわずか6Åしかないためフォールドされたタンパク質は通過できない。
3D variability analysis (3DVA)
クライオ電子顕微鏡の高分解能での解析により得られたマップから、さらに、動的なコンフォメーション変化を伴う、1連の連続したマップ(構造)に分割するアルゴリズム
Punjani, A. & Fleet, D. J. J. Struct. Biol. 213, 107702 (2021).
謝辞
論文情報
| タイトル | 「Cryo-EM structures of the translocational binary toxin complex CDTa-bound CDTb-pore from Clostridioides difficile」 (ディフィシル菌の二成分毒素CDTaが結合したCDTb膜孔複合体のクライオ電子顕微鏡による構造) |
|---|---|
| 掲載誌 | 英国科学誌『Nature Communications』オンライン版 |
| 掲載日 | 2022年10月17日 |
| 研究体制 | 京都産業大学、大阪大学蛋白質研究所、日本女子大学、堀場製作所との共同研究 |
| 著者 | 川本 晃大1 3、山田 等仁1 4、吉田 徹4 5、佐藤 優穂6、加藤 貴之3、 津下 英明2 4 ※ 1筆頭著者、2責任著者、3大阪大学蛋白質研究所、4京都産業大学 5日本女子大学、6堀場製作所 |
| DOI | 10.1038/s41467-022-33888-4 |
- お問い合わせ先
-
内容について:京都産業大学生命科学部 津下 英明 教授
〒603‐8555 京都市北区上賀茂本山
E-Mail: tsuge@cc.kyoto-su.ac.jp
取材について:京都産業大学 広報部
Tel.075-705-1411
