ミトコンドリアのポリンがミトコンドリアタンパク質搬入装置の集合を制御することを発見
2019.02.07
ミトコンドリア(注1)は細胞内で生命活動に必要なエネルギーを産生し、ヒトではその正常機能がヒトの健康につながります。ミトコンドリアの機能低下は老化や神経変性疾患、糖尿病、がんなど様々な病態と関連することが知られています。正常機能のミトコンドリアを維持するためには、ミトコンドリアの外(サイトゾル)からミトコンドリア内にミトコンドリアを構成する1000種におよぶタンパク質を配送する必要があります(注2)。このミトコンドリアへのタンパク質搬入口として働くのが、複数のタンパク質が組み合わさって出来たTOM複合体(注3)です。
今回研究グループは、小分子の代謝物質のミトコンドリアへの出入りを担うポリン(注4)が、Tom22と結合することで、TOM複合体の3量体から2量体への変換を促進することを見いだしました。さらにTOM複合体の3量体と2量体が通過させるタンパク質の種類は異なることも新たに見いだし、TOM複合体は組成を3量体と2量体で変えることで、さまざまなミトコンドリアタンパク質をうまく取り込めること、ポリンはこうした機能変換を助ける働きをしていることがわかりました。またTOM複合体の構成因子Tom6は2量体から3量体への変換を促進することで、ポリンと逆の調節を担いますが、この調節が細胞周期(注5)に依存することも明らかになりました。ミトコンドリアへのタンパク質搬入のメカニズムの解明により、ミトコンドリアへのタンパク質配送に関連する病気の治療法の開発や、老化とミトコンドリアの関係解明へのあらたな糸口が見つかることが期待されます。
今回研究グループは、小分子の代謝物質のミトコンドリアへの出入りを担うポリン(注4)が、Tom22と結合することで、TOM複合体の3量体から2量体への変換を促進することを見いだしました。さらにTOM複合体の3量体と2量体が通過させるタンパク質の種類は異なることも新たに見いだし、TOM複合体は組成を3量体と2量体で変えることで、さまざまなミトコンドリアタンパク質をうまく取り込めること、ポリンはこうした機能変換を助ける働きをしていることがわかりました。またTOM複合体の構成因子Tom6は2量体から3量体への変換を促進することで、ポリンと逆の調節を担いますが、この調節が細胞周期(注5)に依存することも明らかになりました。ミトコンドリアへのタンパク質搬入のメカニズムの解明により、ミトコンドリアへのタンパク質配送に関連する病気の治療法の開発や、老化とミトコンドリアの関係解明へのあらたな糸口が見つかることが期待されます。
リリース日:2019-02-07
背景
ヒトや酵母などの真核生物の細胞内には、ミトコンドリアをはじめとする膜で仕切られた細胞内小器官が存在します。ミトコンドリアは細胞内で生命活動に必須のエネルギー生産を担っており、細胞にとってもヒトの健康にとっても重要な役割を果たしています。ミトコンドリアは外膜と内膜の二枚の生体膜に囲まれ、1000種類以上のタンパク質から構成されていますが、これらのタンパク質のほとんどは、ミトコンドリアの外、すなわちサイトゾルで前駆体として合成されてから、ミトコンドリアの中へ搬入されます(図1)。ミトコンドリアタンパク質前駆体がミトコンドリアに正しく搬入されるのは、前駆体に宛先すなわち「行き先シグナル」が書き込まれているからです。前駆体はミトコンドリア外膜上の受容体によって宛名が読み取られ、トランスロケータ(膜透過装置)が提供する通り道を介することで、通り道なしではタンパク質等の高分子は通過させない外膜を効率よく通過して、ミトコンドリア内に取り込まれますが、ひとつの搬入口で、構造も性質も異なる1000種類以上のタンパク質をどのように効率よく搬入しているかは大きな謎でした。
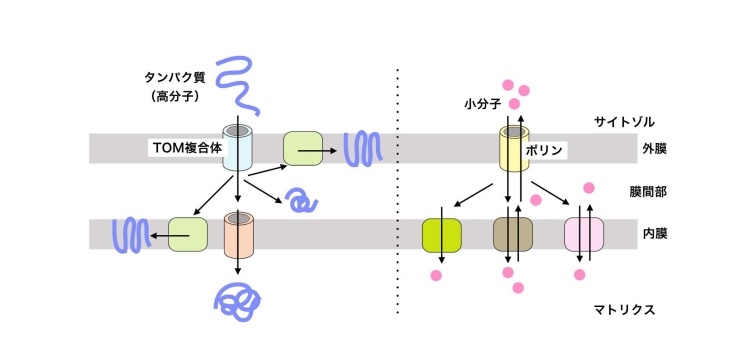
一方、ミトコンドリアの重要な機能であるエネルギー産生やアミノ酸・脂質などの代謝においては、サイトゾルからミトコンドリアの中に代謝物質を取り込み、それらを適切に変換した後、サイトゾルに送り出さねばなりません。こうした比較的小さな代謝物質のミトコンドリア内外の出入りを担うのが、外膜に「孔」を形成するタンパク質のポリンです(図2)。ポリンは実際、筒状の構造をしており、その中を小さな代謝物質が比較的自由に出入りできると考えられています。
これまでミトコンドリアの外膜で小分子の輸送を担うポリンと、高分子のタンパク質の輸送を担うTOM複合体のような膜透過装置との関係はまったく知られていませんでした。
一方、ミトコンドリアの重要な機能であるエネルギー産生やアミノ酸・脂質などの代謝においては、サイトゾルからミトコンドリアの中に代謝物質を取り込み、それらを適切に変換した後、サイトゾルに送り出さねばなりません。こうした比較的小さな代謝物質のミトコンドリア内外の出入りを担うのが、外膜に「孔」を形成するタンパク質のポリンです(図2)。ポリンは実際、筒状の構造をしており、その中を小さな代謝物質が比較的自由に出入りできると考えられています。
これまでミトコンドリアの外膜で小分子の輸送を担うポリンと、高分子のタンパク質の輸送を担うTOM複合体のような膜透過装置との関係はまったく知られていませんでした。
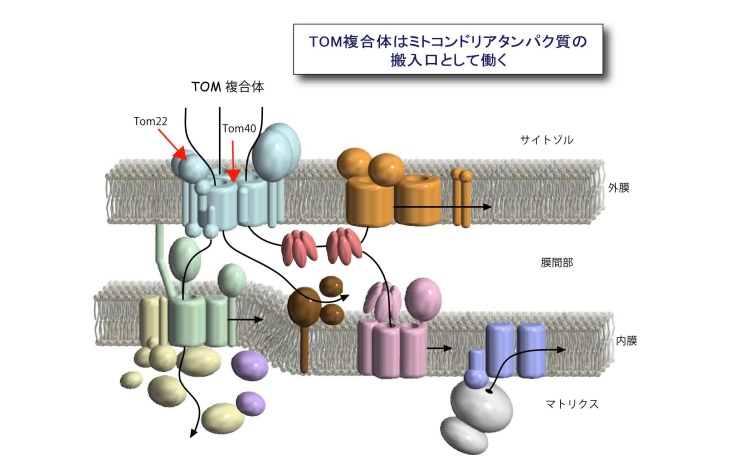
1000種類以上のタンパク質のミトコンドリアへの配送経路(黒矢印)。サイトゾルで合成されたミトコンドリア前駆体タンパク質の大部分は搬入口TOM複合体を通って外膜を通過し、目的区画に仕分けられる。TOM複合体は受容体や前駆体タンパク質の通り道を提供するTom40およびTom40を糊付けするTom22等から構成される。
研究成果
(1)タンパク質の搬入口TOM複合体からはずれたTom22にポリンが結合する
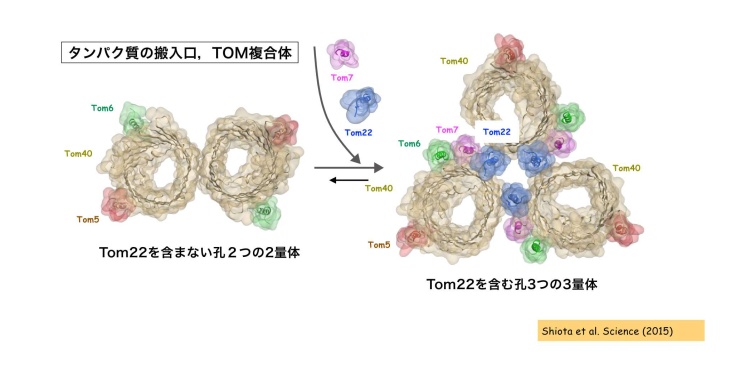
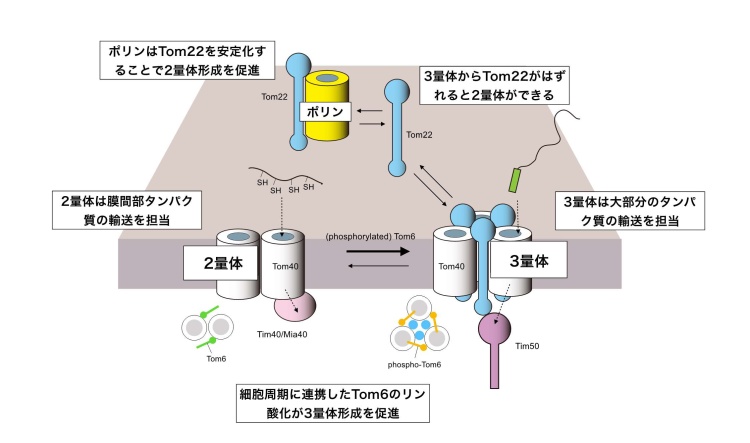
私たちは、TOM複合体は「孔」として機能するTom40が3分子集まって孔が3つの3量体複合体を作ること、このとき別のサブユニットのTom22がTom40どうしを集合させる糊の役割を果たしていることを報告しました(Shiotaら、Science 2015)。さらにこの3量体は、糊のTom22が外れることで一部が壊れてTom40が2分子から成る孔2つの2量体に可逆的に変換する、すなわちTom40は大部分が3量体にあるものの、一部は2量体との間を往き来することも見いだしていました(図3)。今回私たちは、3量体と2量体の往き来の鍵を握るTom22に注目し、3量体からはずれたTom22にミトコンドリアのポリンが結合することを見いだしました。
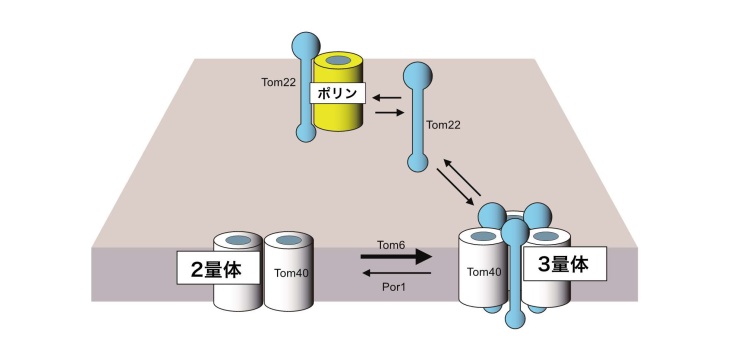
新規にミトコンドリアの外で合成されたTom22は、ミトコンドリア内に取り込まれて、TOM複合体に組み込まれます。このとき、TOM複合体に組み込まれる前のTom22は一過的にポリンに結合し、タイミングを見計らってTom22と相互作用していないTom40分子に結合し、TOM複合体3量体に組み立てられることがわかりました。ポリンは新しくミトコンドリアに入ってきて、相手がまだ見つからないTom22の一時的な介添え役(シャペロン)として働くものと考えられます(図4)。
(2)ポリンはTOM複合体の3量体から2量体への変換を助ける
ポリンは、新たにミトコンドリアに入ってきたTom22だけでなく、いったん組み立てられたTOM複合体3量体から一時的にはずれたTom22に結合することで、TOM複合体3量体(Tom22を含む)からTOM複合体2量体(Tom22を含まない)を作る働きがあることもわかりました。逆に2量体を3量体に戻す働きが考えられているのがTOM複合体のもう一つのサブユニットのTom6です。ポリンはTOM複合体2量体をつくり、Tom6はTOM複合体3量体をつくる、という逆の働きをしていることになります(図4)。
(3)TOM複合体3量体と2量体は通過させるタンパク質の種類が異なる
通常TOM複合体は大部分が3量体として存在し、2量体は一過的にしかつくられないのですが、それではなぜわざわざ2量体をつくる必要があるのでしょうか。今回私たちは、TOM複合体の3量体と2量体は、通過させるタンパク質が異なることを見いだしました。すなわち、大部分のミトコンドリアタンパク質はTOM複合体3量体を通ってミトコンドリア内に取り込まれますが、膜間部の可溶性タンパク質はTOM複合体2量体を通ってミトコンドリア内に取り込まれることを見いだしました。ポリンを欠失させると、2量体が作られにくくなり、TOM複合体はすべて3量体になりますが、そうすると、膜間部の可溶性タンパク質のミトコンドリア内への取り込みができなくなったのです(図5)。ミトコンドリアタンパク質の搬入口TOM複合体は、その組成を3量体と2量体で変えることで、1000種類に及ぶさまざまなミトコンドリアタンパク質をうまく取り込めるようになっているのではないかと考えられます。
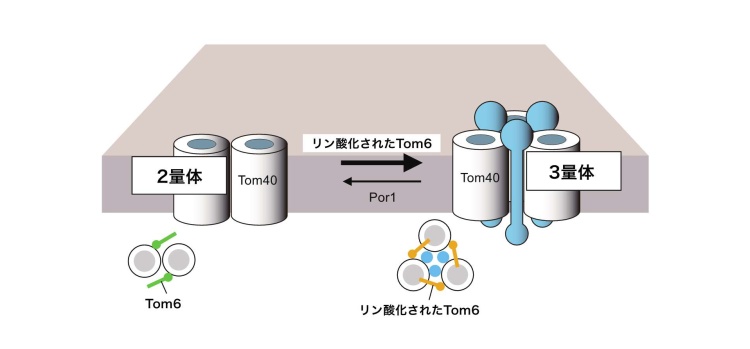
(4)TOM複合体3量体と2量体は細胞周期と連携する
ポリンとは逆に、Tom6は2量体から3量体への変換を促進しますが、この変換が細胞周期に依存することも見いだしました。Tom6は細胞周期依存的にリン酸化されますが、このリン酸化が2量体と3量体の安定性を変えていることがわかりました(図6)。細胞周期に依存して、ミトコンドリアが必要とするタンパク質の種類が異なり、そうしたタンパク質の種類の変化にうまく対応できるよう、2量体と3量体の量比が微調整されているのかもしれません。
(5)結論
今回、ミトコンドリアで小分子の輸送を担うポリンが、高分子のタンパク質の輸送を担うTOM複合体の機能を制御することで、両者が連携しあってミトコンドリアを作っていく、という新たなミトコンドリアの機能調節モデルが生まれました。
私たちは、TOM複合体は「孔」として機能するTom40が3分子集まって孔が3つの3量体複合体を作ること、このとき別のサブユニットのTom22がTom40どうしを集合させる糊の役割を果たしていることを報告しました(Shiotaら、Science 2015)。さらにこの3量体は、糊のTom22が外れることで一部が壊れてTom40が2分子から成る孔2つの2量体に可逆的に変換する、すなわちTom40は大部分が3量体にあるものの、一部は2量体との間を往き来することも見いだしていました(図3)。今回私たちは、3量体と2量体の往き来の鍵を握るTom22に注目し、3量体からはずれたTom22にミトコンドリアのポリンが結合することを見いだしました。
新規にミトコンドリアの外で合成されたTom22は、ミトコンドリア内に取り込まれて、TOM複合体に組み込まれます。このとき、TOM複合体に組み込まれる前のTom22は一過的にポリンに結合し、タイミングを見計らってTom22と相互作用していないTom40分子に結合し、TOM複合体3量体に組み立てられることがわかりました。ポリンは新しくミトコンドリアに入ってきて、相手がまだ見つからないTom22の一時的な介添え役(シャペロン)として働くものと考えられます(図4)。
(2)ポリンはTOM複合体の3量体から2量体への変換を助ける
ポリンは、新たにミトコンドリアに入ってきたTom22だけでなく、いったん組み立てられたTOM複合体3量体から一時的にはずれたTom22に結合することで、TOM複合体3量体(Tom22を含む)からTOM複合体2量体(Tom22を含まない)を作る働きがあることもわかりました。逆に2量体を3量体に戻す働きが考えられているのがTOM複合体のもう一つのサブユニットのTom6です。ポリンはTOM複合体2量体をつくり、Tom6はTOM複合体3量体をつくる、という逆の働きをしていることになります(図4)。
(3)TOM複合体3量体と2量体は通過させるタンパク質の種類が異なる
通常TOM複合体は大部分が3量体として存在し、2量体は一過的にしかつくられないのですが、それではなぜわざわざ2量体をつくる必要があるのでしょうか。今回私たちは、TOM複合体の3量体と2量体は、通過させるタンパク質が異なることを見いだしました。すなわち、大部分のミトコンドリアタンパク質はTOM複合体3量体を通ってミトコンドリア内に取り込まれますが、膜間部の可溶性タンパク質はTOM複合体2量体を通ってミトコンドリア内に取り込まれることを見いだしました。ポリンを欠失させると、2量体が作られにくくなり、TOM複合体はすべて3量体になりますが、そうすると、膜間部の可溶性タンパク質のミトコンドリア内への取り込みができなくなったのです(図5)。ミトコンドリアタンパク質の搬入口TOM複合体は、その組成を3量体と2量体で変えることで、1000種類に及ぶさまざまなミトコンドリアタンパク質をうまく取り込めるようになっているのではないかと考えられます。
(4)TOM複合体3量体と2量体は細胞周期と連携する
ポリンとは逆に、Tom6は2量体から3量体への変換を促進しますが、この変換が細胞周期に依存することも見いだしました。Tom6は細胞周期依存的にリン酸化されますが、このリン酸化が2量体と3量体の安定性を変えていることがわかりました(図6)。細胞周期に依存して、ミトコンドリアが必要とするタンパク質の種類が異なり、そうしたタンパク質の種類の変化にうまく対応できるよう、2量体と3量体の量比が微調整されているのかもしれません。
(5)結論
今回、ミトコンドリアで小分子の輸送を担うポリンが、高分子のタンパク質の輸送を担うTOM複合体の機能を制御することで、両者が連携しあってミトコンドリアを作っていく、という新たなミトコンドリアの機能調節モデルが生まれました。
今後の展望
今回の結果は、これまで「ミトコンドリア内外の代謝物質の輸送に関わる孔」と考えられてきたポリンが、タンパク質の輸送を担うTOM複合体の機能調節にも関わることを明らかにしたもので、小分子の代謝物質と、高分子のタンパク質のミトコンドリアへの輸送を、ポリンという1つのタンパク質が調節している、という点で大きなインパクトをもちます。
本研究で解析した酵母TOM複合体は、ヒト細胞でも同じメカニズムでタンパク質の搬入口・膜透過装置として働くと考えられています。したがって、本研究で明らかになったポリンを介したTOM複合体の機能制御は、ヒトのTOM複合体にもあてはまるものと考えられます。すなわち本研究で明らかになったミトコンドリアへのタンパク質搬入口複合体の機能制御の仕組みは、ヒト等の高等生物における同様のメカニズムの理解に直結し、ミトコンドリアタンパク質の搬入と関連するパーキンソン病などの神経変性疾患や、難病で治療法開発が待たれているミトコンドリア病の病因メカニズム解明に資することが期待されます。将来的には、ミトコンドリアへのタンパク質の取り込みの特異性や効率の制御により、ミトコンドリア機能や細胞機能を制御することで、未開発だったミトコンドリア病の治療法開発に道筋をつけることや老化の予防に繋がることも期待されます。
本研究で解析した酵母TOM複合体は、ヒト細胞でも同じメカニズムでタンパク質の搬入口・膜透過装置として働くと考えられています。したがって、本研究で明らかになったポリンを介したTOM複合体の機能制御は、ヒトのTOM複合体にもあてはまるものと考えられます。すなわち本研究で明らかになったミトコンドリアへのタンパク質搬入口複合体の機能制御の仕組みは、ヒト等の高等生物における同様のメカニズムの理解に直結し、ミトコンドリアタンパク質の搬入と関連するパーキンソン病などの神経変性疾患や、難病で治療法開発が待たれているミトコンドリア病の病因メカニズム解明に資することが期待されます。将来的には、ミトコンドリアへのタンパク質の取り込みの特異性や効率の制御により、ミトコンドリア機能や細胞機能を制御することで、未開発だったミトコンドリア病の治療法開発に道筋をつけることや老化の予防に繋がることも期待されます。
備考
本研究は、日本学術振興会(JSPS)科学研究費補助金の特別推進研究「ミトコンドリア生合成を司る細胞内統合的ネットワークの解明」、および科学技術振興機構(JST) 戦略的創造研究推進事業 チーム型研究(CREST)の研究領域「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術(研究総括:田中啓二(東京都医学総合研究所 所長))」における研究課題「ミトコンドリアをハブとする構造機能ネットワークの解明」の一環として行われました。
※用語・事項の解説
- ミトコンドリア
酵母からヒトまで広く真核生物の細胞内に見られる必須のオルガネラ(細胞小器官)。生命活動に必要なエネルギー(ATP)を酸素呼吸によって産生するほか、さまざまな物質の代謝やアポトーシスにも関わる。ミトコンドリアの機能低下や機能異常と老化やがん、糖尿病、さまざまなミトコンドリア病との関連がわかっている。ミトコンドリアの機能を健全に保つことがヒトの健康に重要であることから、健全なミトコンドリアを増やす方法が注目されている。 - タンパク質の配送機構
細胞内で合成されたタンパク質は、働くべき目的地に正しく配送される必要がある。ブローベルらはタンパク質には宅配便のように自分自身に宛名が書き込まれており、それを目的地の装置(トランスロケータの受容体)が読み取る、という原理があることを発見した(1999年ノーベル生理学医学賞)。シェクマンとロスマンは、さらに小胞体からリソゾーム、細胞膜を含む細胞内膜系の間のタンパク質の輸送が小胞を介して行われ、小胞を生み出す膜、小胞、目的地の膜の間でタンパク質の選別の原理が働くことを見出した(2013年ノーベル生理学医学賞)。このようにタンパク質の宛名や選別の仕組みについては理解が進んできたが、トランスロケータがタンパク質をどう膜透過させるのか、などの詳細な仕組みの解明に必須となるトランスロケータの構造については、原核生物等一部の膜系のものについてしか明らかになっていない。 - TOM複合体
酵母からヒトまで保存されているミトコンドリア外膜のトランスロケータ(膜透過装置)で、800種(酵母)〜1500種(ヒト)におよぶ、ほとんどすべてのミトコンドリアタンパク質のミトコンドリアへの搬入口として働く。ミトコンドリア行きシグナルを認識する受容体、ミトコンドリアタンパク質前駆体の外膜透過を行うTom40、複合体の集合に重要なTom22など7〜8種類のサブユニットから構成される膜タンパク質複合体。 - ポリン
酵母からヒトまで進化的に保存されたミトコンドリアの外膜のチャネルタンパク質(筒状のバレル型膜タンパク質)で、ミトコンドリアとサイトゾルの間の代謝物質(分子量数千以下の小分子)の輸送を担う。ヒトなどの哺乳動物ではVDAC(電位依存性陰イオンチャネル)と呼ばれる。ミトコンドリアの様々な機能において重要な役割を果たし、アポトーシスにも関わることから、創薬のターゲットとしても注目される。 - 細胞周期
細胞が増えるときは、まずDNAの複製が行われ(S期)、複製が完了すると次に細胞が2つの娘細胞に分かれて、DNAが各々に分配される(M期)。この一連のイベントの進行を細胞周期とよぶ。イベントの順番が狂うと娘細胞にDNAが正しく伝わらないため、細胞周期の進行を厳密にチェックし、間違いが生じないようにする仕組みが存在する。
研究論文情報
「Porin associates with Tom22 to regulate the mitochondrial protein gate assembly」
(ポリンはTom22への結合を介してミトコンドリアタンパク質搬入装置の集合を制御する)
著者(1筆頭著者、2責任著者)
阪上 春花1、河野 慎、遠藤 斗志也2 (京都産業大学)
塩田 拓也 (宮崎大学)
塩田 拓也、Kher Shing Tan、 Trever Lithgow(オーストラリア・モナシュ大学)
石坂 直也、瀧 健太朗 (名古屋大学)
田村 康 (山形大学)
今井 賢一郎、本野 千恵、広川 貴次(産業技術総合研究所)
広川 貴次(つくば大学)
宮田 暖、久下 理(九州大学)
(ポリンはTom22への結合を介してミトコンドリアタンパク質搬入装置の集合を制御する)
著者(1筆頭著者、2責任著者)
阪上 春花1、河野 慎、遠藤 斗志也2 (京都産業大学)
塩田 拓也 (宮崎大学)
塩田 拓也、Kher Shing Tan、 Trever Lithgow(オーストラリア・モナシュ大学)
石坂 直也、瀧 健太朗 (名古屋大学)
田村 康 (山形大学)
今井 賢一郎、本野 千恵、広川 貴次(産業技術総合研究所)
広川 貴次(つくば大学)
宮田 暖、久下 理(九州大学)
- お問い合わせ先
-
京都産業大学 広報部
〒603‐8555 京都市北区上賀茂本山
Tel.075-705-1411
Fax.075-705-1987
kouhou-bu@star.kyoto-su.ac.jp
