エントロピーが駆動する新たなミトコンドリアタンパク質輸送機構を発見
2019.02.04
ミトコンドリア(注1)は細胞内で生命活動に必要なエネルギーを産生し、ヒトではその正常機能がヒトの健康につながります。ミトコンドリアの機能低下は老化や神経変性疾患、糖尿病、がんなど様々な病態と関連することが知られています。正常機能のミトコンドリアを維持するためには、ミトコンドリアの外(サイトゾル)からミトコンドリア内にミトコンドリアを構成する1000種におよぶタンパク質を配送する必要があります(注2)。輸送されるタンパク質の中には、ミトコンドリアの機能に重要な内膜のクリステ構造をつくるMICOS複合体(注3)の構成因子もあります。
今回研究グループは、酵母のMICOS複合体を構成する6種の因子のうち、Mic19にしっかりした立体構造をとらない長い領域があると、MIA経路(注4)による膜間部への輸送が阻害され、その解除にはMic19のミリストイル化(注5)が必要であることを見いだしました。またMic19がミリストイル化されると、ミトコンドリアの外膜や、外膜の膜透過装置TOM複合体の受容体Tom20への結合が促進されることも見いだしました。立体構造をとらない長い領域があると、Mic19はミトコンドリアの外でのエントロピー(注6)が特に高く、そのままでは、TOM複合体の狭い孔には入りにくくなります。ところが、Mic19をミトコンドリアの外膜やTom20に結合させると、ミトコンドリアの外で自由に動き回れる空間が小さくなる、つまりはエントロピーが下がることで、TOM複合体への輸送がスムーズに行われるようになります。
こうしたエントロピーにより駆動される輸送はこれまで想定されていませんでしたが、 N-ミリストイル化は哺乳動物のミトコンドリアタンパク質などで見いだされており、こうしたメカニズムが単にMic19のみに見られるのではなく、一般的な輸送の仕組みとして働くことが考えられます。
今回研究グループは、酵母のMICOS複合体を構成する6種の因子のうち、Mic19にしっかりした立体構造をとらない長い領域があると、MIA経路(注4)による膜間部への輸送が阻害され、その解除にはMic19のミリストイル化(注5)が必要であることを見いだしました。またMic19がミリストイル化されると、ミトコンドリアの外膜や、外膜の膜透過装置TOM複合体の受容体Tom20への結合が促進されることも見いだしました。立体構造をとらない長い領域があると、Mic19はミトコンドリアの外でのエントロピー(注6)が特に高く、そのままでは、TOM複合体の狭い孔には入りにくくなります。ところが、Mic19をミトコンドリアの外膜やTom20に結合させると、ミトコンドリアの外で自由に動き回れる空間が小さくなる、つまりはエントロピーが下がることで、TOM複合体への輸送がスムーズに行われるようになります。
こうしたエントロピーにより駆動される輸送はこれまで想定されていませんでしたが、 N-ミリストイル化は哺乳動物のミトコンドリアタンパク質などで見いだされており、こうしたメカニズムが単にMic19のみに見られるのではなく、一般的な輸送の仕組みとして働くことが考えられます。
リリース日:2019-02-04
背景
ヒトや酵母などの真核生物の細胞内には、ミトコンドリアをはじめとする膜で仕切られた細胞内小器官が存在します。ミトコンドリアは細胞内で生命活動に必須のエネルギー生産を担っており、細胞にとってもヒトの健康にとっても重要な役割を果たしています。ミトコンドリアは外膜と内膜の二枚の生体膜に囲まれ、1000種類以上のタンパク質から構成されていますが、これらのタンパク質のほとんどは、ミトコンドリアの外、すなわちサイトゾルで前駆体として合成されてから、ミトコンドリアの中へ搬入されます。ミトコンドリアタンパク質前駆体がミトコンドリアに正しく搬入されるのは、前駆体に宛先すなわち「行き先シグナル」が書き込まれているからです。前駆体はミトコンドリア外膜上の受容体によって宛名が読み取られ、トランスロケータ(膜透過装置)が提供する通り道を介することで、通り道なしではタンパク質等の高分子は通過させない外膜を効率よく通過して、ミトコンドリア内に取り込まれます。ほとんどすべてのミトコンドリアタンパク質は外膜のトランスロケータであるTOM複合体を介して外膜を通過しますが、その後、ミトコンドリアタンパク質の輸送経路は外膜、膜間部、内膜、マトリクスという最終目的地に応じて、分かれることになります(図1)。
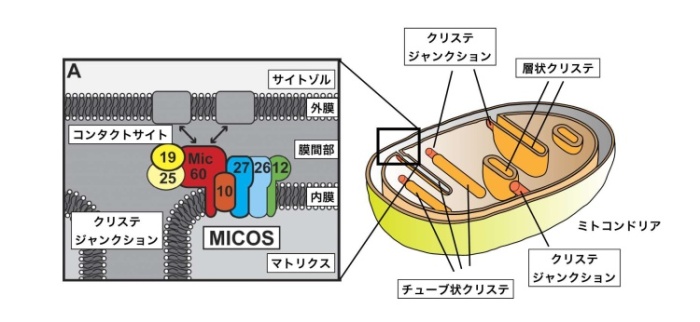
ミトコンドリアの内膜にはクリステと呼ばれるエネルギー産生に必要な酸化的リン酸化に関わるタンパク質を集積する構造があり、このクリステ形成には、内膜のMICOS複合体が必須です(図2)。MICOS複合体はクリステ構造の根元部分(クリステジャンクション)の形成を担うとともに、外膜と内膜の近接部位(コンタクトサイト)形成にも関わっています。MICOS複合体は酵母では6種類のタンパク質から構成され、ヒトではこれにさらにいくつかのタンパク質が加わってできています。MICOS複合体の構成因子の1つであるMic19は、MIA経路と呼ばれる経路で膜間部に輸送されることとMic19のN端の脂肪酸修飾であるミリストイル化が必要であることが報告されていましたが、ミリストイル化がなぜ必要なのかはまったくわかっていませんでした。
ミトコンドリアの内膜にはクリステと呼ばれるエネルギー産生に必要な酸化的リン酸化に関わるタンパク質を集積する構造があり、このクリステ形成には、内膜のMICOS複合体が必須です(図2)。MICOS複合体はクリステ構造の根元部分(クリステジャンクション)の形成を担うとともに、外膜と内膜の近接部位(コンタクトサイト)形成にも関わっています。MICOS複合体は酵母では6種類のタンパク質から構成され、ヒトではこれにさらにいくつかのタンパク質が加わってできています。MICOS複合体の構成因子の1つであるMic19は、MIA経路と呼ばれる経路で膜間部に輸送されることとMic19のN端の脂肪酸修飾であるミリストイル化が必要であることが報告されていましたが、ミリストイル化がなぜ必要なのかはまったくわかっていませんでした。
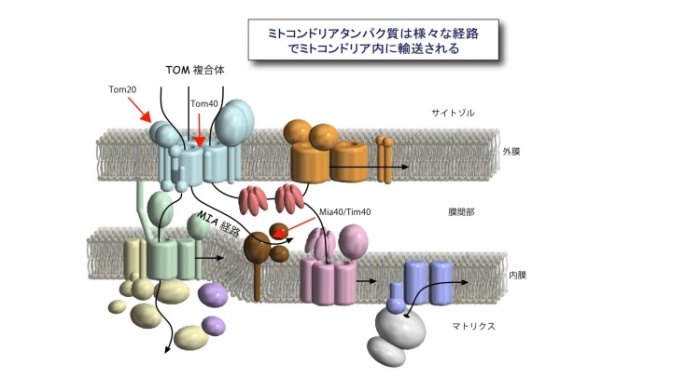
1000種類以上のタンパク質のミトコンドリアへの配送経路(黒矢印)。サイトゾルで合成されたミトコンドリア前駆体タンパク質の大部分は搬入口TOM複合体を通って外膜を通過し、目的区画に仕分けられる。膜間部の可溶性タンパク質はTOM複合体を通って外膜を通過した後、膜間部でMia40(Tim40)に受け渡されてMIA経路で輸送される。
研究成果
(1)MICOS構成因子のうち、Mic19はMIA経路で膜間部に輸送され、輸送にはミリストイル化が必要である。
私たちは、単離したミトコンドリアに、試験管内で合成したタンパク質を取り込ませる、in vitroインポート実験系を使って、MICOS複合体をつくる6種のタンパク質の輸送経路を調べました。その結果、Mic19以外のタンパク質はTOM複合体とTIM23複合体を使って内膜に輸送されますが、Mic19はTOM複合体を使って外膜を通過した後、MIA経路で膜間部に輸送され、MICOS複合体に組み込まれることがわかりました。
MIA経路での輸送に必要なのはMic19のCHCHドメインという部分ですが、その前に機能不明のDUFドメインと呼ばれる部分があり、さらにその前のN端にはミリストイル化モチーフがあります。そして、ミリストイル化モチーフも、Mic19の膜間部への輸送に必要であること、実際Mic19はミリストイル化モチーフにミリストイル基が付加されることを確かめました。しかし不思議なことに、他のMIA経路で輸送されるタンパク質はミリストイル化モチーフを必要とせず、人為的にミリストイル化モチーフを付加すると輸送速度が低下することがわかりました。
(2)Mic19の輸送は、立体構造をとらないドメインの存在で阻害され、その解除にミリストイル化が必要
それでは、なぜMIA経路によるMic19の輸送にだけミリストイル化が必要なのでしょうか。Mic19ではMIA経路での輸送に必要なCHCHドメインの前に、長いDUFドメインがあります。そこでDUFドメインを他のMIA経路で輸送されるタンパク質に付加したところ、輸送が阻害されました。しかしDUFドメインの前にミリストイル化モチーフも付加すると、輸送阻害は解除されました。つまり、Mic19が膜間部への輸送にミリストイル化モチーフを必要とするのは、DUFドメインがあったからだと考えられました。
Mic19のDUFドメインはしっかりした立体構造をとっていません。そこで、DUFドメインとは全く関係ない、しっかりした立体構造をとらない別のタンパク質領域をMic19のCHCHドメインに付加したところ、やはり膜間部への輸送が阻害され、その阻害の解除にはミリストイル化モチーフが必要でした。また膜間部への輸送の阻害は立体構造をとらない別のタンパク質においても、領域の長さが長いほど強くなることもわかりました。つまりしっかりした立体構造をとらない長い領域があると膜間部への輸送が阻害され、その解除にミリストイル化モチーフが必要であることになります。
(3)ミリストイル化はミトコンドリア外膜とTom20への結合を促進
それでは、ミリストイル化の役割は何なのでしょうか。今回、Mic19がミリストイル化されると、ミトコンドリアの外膜に結合しやすくなること、さらに外膜のTOM複合体の受容体サブユニットであるTom20にも結合しやすくなることを見いだしました。Mic19のミリストイル基は、Mic19はミトコンドリアの外膜やTom20に結合させることで、DUFドメインのようなしっかりした立体構造をとらない部分による膜間部への輸送阻害を解除する仕組みがあることが考えられます。
(4)エントロピーが駆動するMic19ミリストイル化を介した輸送
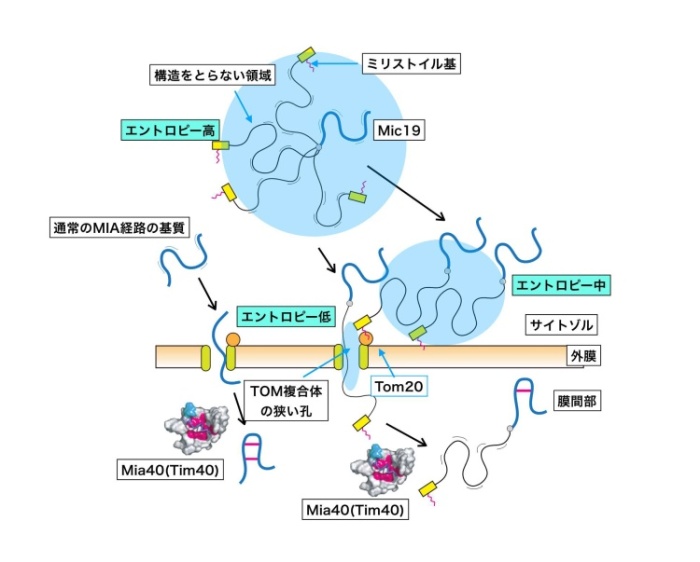
一般に、 ミトコンドリアの外で、しっかりした立体構造をとっていないタンパク質が、TOM複合体の狭い孔に入るのは簡単ではありません。飛び回っている蝶を狭い虫かごに導こうとしてもうまくいかないようなものです。このことは、ミトコンドリアの外の広い空間では、立体構造をとっていないタンパク質はたくさんの構造状態をとれるのでエントロピーが高いが、TOM複合体の狭い孔の中では、取れる構造状態の数が減ってしまうのでエントロピーが低い。エントロピーが高い状態から低い状態に物事は進みにくい、と考えることができます。通常は、ミトコンドリアタンパク質は、TOM複合体の孔の内側と相互作用し、また孔の出口で待っている下流の因子と相互作用するなどによって、この問題を回避できています。
ところが、Mic19の場合は、立体構造をとらない長いDUFドメインがあるため、ミトコンドリアの外でのエントロピーが特に高く、そのままでは、TOM複合体の孔には入ることは困難になります。ところがミリストイル基によってMic19をミトコンドリアの外膜やTom20に結合させると、ミトコンドリアの外で自由に動き回れる空間が膜から離れた時に比べて小さくなり、その結果、取り得る構造状態の数も減ります。つまりエントロピーが下がります。そうするともはや立体構造をとらない長いDUFドメインがあることで不利だった高いエントロピーの問題が解消され、TOM複合体の狭い孔へスムーズに入ることになります。(図3)。
こうした「エントロピーの調節によって駆動される輸送」はこれまで想定されていませんでしたが、 N-ミリストイル化は哺乳動物のミトコンドリアタンパク質などで見いだされており、こうしたメカニズムが単にMic19のみに見られるのではなく、一般的な仕組みとして働くことが考えられます。
私たちは、単離したミトコンドリアに、試験管内で合成したタンパク質を取り込ませる、in vitroインポート実験系を使って、MICOS複合体をつくる6種のタンパク質の輸送経路を調べました。その結果、Mic19以外のタンパク質はTOM複合体とTIM23複合体を使って内膜に輸送されますが、Mic19はTOM複合体を使って外膜を通過した後、MIA経路で膜間部に輸送され、MICOS複合体に組み込まれることがわかりました。
MIA経路での輸送に必要なのはMic19のCHCHドメインという部分ですが、その前に機能不明のDUFドメインと呼ばれる部分があり、さらにその前のN端にはミリストイル化モチーフがあります。そして、ミリストイル化モチーフも、Mic19の膜間部への輸送に必要であること、実際Mic19はミリストイル化モチーフにミリストイル基が付加されることを確かめました。しかし不思議なことに、他のMIA経路で輸送されるタンパク質はミリストイル化モチーフを必要とせず、人為的にミリストイル化モチーフを付加すると輸送速度が低下することがわかりました。
(2)Mic19の輸送は、立体構造をとらないドメインの存在で阻害され、その解除にミリストイル化が必要
それでは、なぜMIA経路によるMic19の輸送にだけミリストイル化が必要なのでしょうか。Mic19ではMIA経路での輸送に必要なCHCHドメインの前に、長いDUFドメインがあります。そこでDUFドメインを他のMIA経路で輸送されるタンパク質に付加したところ、輸送が阻害されました。しかしDUFドメインの前にミリストイル化モチーフも付加すると、輸送阻害は解除されました。つまり、Mic19が膜間部への輸送にミリストイル化モチーフを必要とするのは、DUFドメインがあったからだと考えられました。
Mic19のDUFドメインはしっかりした立体構造をとっていません。そこで、DUFドメインとは全く関係ない、しっかりした立体構造をとらない別のタンパク質領域をMic19のCHCHドメインに付加したところ、やはり膜間部への輸送が阻害され、その阻害の解除にはミリストイル化モチーフが必要でした。また膜間部への輸送の阻害は立体構造をとらない別のタンパク質においても、領域の長さが長いほど強くなることもわかりました。つまりしっかりした立体構造をとらない長い領域があると膜間部への輸送が阻害され、その解除にミリストイル化モチーフが必要であることになります。
(3)ミリストイル化はミトコンドリア外膜とTom20への結合を促進
それでは、ミリストイル化の役割は何なのでしょうか。今回、Mic19がミリストイル化されると、ミトコンドリアの外膜に結合しやすくなること、さらに外膜のTOM複合体の受容体サブユニットであるTom20にも結合しやすくなることを見いだしました。Mic19のミリストイル基は、Mic19はミトコンドリアの外膜やTom20に結合させることで、DUFドメインのようなしっかりした立体構造をとらない部分による膜間部への輸送阻害を解除する仕組みがあることが考えられます。
(4)エントロピーが駆動するMic19ミリストイル化を介した輸送
一般に、 ミトコンドリアの外で、しっかりした立体構造をとっていないタンパク質が、TOM複合体の狭い孔に入るのは簡単ではありません。飛び回っている蝶を狭い虫かごに導こうとしてもうまくいかないようなものです。このことは、ミトコンドリアの外の広い空間では、立体構造をとっていないタンパク質はたくさんの構造状態をとれるのでエントロピーが高いが、TOM複合体の狭い孔の中では、取れる構造状態の数が減ってしまうのでエントロピーが低い。エントロピーが高い状態から低い状態に物事は進みにくい、と考えることができます。通常は、ミトコンドリアタンパク質は、TOM複合体の孔の内側と相互作用し、また孔の出口で待っている下流の因子と相互作用するなどによって、この問題を回避できています。
ところが、Mic19の場合は、立体構造をとらない長いDUFドメインがあるため、ミトコンドリアの外でのエントロピーが特に高く、そのままでは、TOM複合体の孔には入ることは困難になります。ところがミリストイル基によってMic19をミトコンドリアの外膜やTom20に結合させると、ミトコンドリアの外で自由に動き回れる空間が膜から離れた時に比べて小さくなり、その結果、取り得る構造状態の数も減ります。つまりエントロピーが下がります。そうするともはや立体構造をとらない長いDUFドメインがあることで不利だった高いエントロピーの問題が解消され、TOM複合体の狭い孔へスムーズに入ることになります。(図3)。
こうした「エントロピーの調節によって駆動される輸送」はこれまで想定されていませんでしたが、 N-ミリストイル化は哺乳動物のミトコンドリアタンパク質などで見いだされており、こうしたメカニズムが単にMic19のみに見られるのではなく、一般的な仕組みとして働くことが考えられます。
今後の展望
今回の結果は、細胞内でのタンパク質の輸送の原動力として、これまで見落とされていた「エントロピー」という視点の重要さを明らかにしたもので、今後、同様の仕組みがいろいろと見つかってくることが考えられます。
本研究で解析した酵母Mic19は、ヒトでも保存され、やはりミリストイル化の必要性が報告されています。すなわち本研究で明らかになった、エントロピー駆動型のタンパク質輸送は、ヒト等の高等生物におけるミトコンドリア機能と直結するクリステ形成の仕組みの同様のメカニズムの理解に直結します。ミトコンドリアの機能低下が原因である難病で治療法開発が待たれているミトコンドリア病の病因メカニズム解明にも資することが期待されます。将来的にはエントロピーを考慮することで、ミトコンドリアへのタンパク質の取り込みの効率の向上によりミトコンドリア機能や細胞機能を制御したり、未開発だったミトコンドリア病の治療法開発に道筋をつけることも期待されます。
本研究で解析した酵母Mic19は、ヒトでも保存され、やはりミリストイル化の必要性が報告されています。すなわち本研究で明らかになった、エントロピー駆動型のタンパク質輸送は、ヒト等の高等生物におけるミトコンドリア機能と直結するクリステ形成の仕組みの同様のメカニズムの理解に直結します。ミトコンドリアの機能低下が原因である難病で治療法開発が待たれているミトコンドリア病の病因メカニズム解明にも資することが期待されます。将来的にはエントロピーを考慮することで、ミトコンドリアへのタンパク質の取り込みの効率の向上によりミトコンドリア機能や細胞機能を制御したり、未開発だったミトコンドリア病の治療法開発に道筋をつけることも期待されます。
助成
本研究は、日本学術振興会(JSPS)科学研究費補助金の特別推進研究「ミトコンドリア生合成を司る細胞内統合的ネットワークの解明」、および科学技術振興機構(JST) 戦略的創造研究推進事業 チーム型研究(CREST)の研究領域「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術(研究総括:田中啓二(東京都医学総合研究所 所長))」における研究課題「ミトコンドリアをハブとする構造機能ネットワークの解明」の一環として行われました。
※用語・事項の解説
- ミトコンドリア:酵母からヒトまで広く真核生物の細胞内に見られる必須のオルガネラ(細胞小器官)。生命活動に必要なエネルギー(ATP)を酸素呼吸によって産生するほか、さまざまな物質の代謝やアポトーシスにも関わる。ミトコンドリアの機能低下や機能異常と老化やがん、糖尿病、さまざまなミトコンドリア病との関連がわかっている。ミトコンドリアの機能を健全に保つことがヒトの健康に重要であることから、健全なミトコンドリアを増やす方法が注目されている。
- タンパク質の配送機構:細胞内で合成されたタンパク質は、働くべき目的地に正しく配送される必要がある。ブローベルらはタンパク質には宅配便のように自分自身に宛名が書き込まれており、それを目的地の装置(トランスロケータの受容体)が読み取る、という原理があることを発見した(1999年ノーベル生理学医学賞)。シェクマンとロスマンは、さらに小胞体からリソゾーム、細胞膜を含む細胞内膜系の間のタンパク質の輸送が小胞を介して行われ、小胞を生み出す膜、小胞、目的地の膜の間でタンパク質の選別の原理が働くことを見出した(2013年ノーベル生理学医学賞)。このようにタンパク質の宛名や選別の仕組みについては理解が進んできたが、高分子であるタンパク質が目的地に効率よく運ばれる仕組みや、その原動力については、まだ謎が多い。
- MICOS複合体:ミトコンドリアは内膜を陥入させてチューブ状または層状の「クリステ」と呼ばれる構造をつくる。クリステには、エネルギー産生に必要な酸化的リン酸化を担う大量のタンパク質が集積し、ミトコンドリアのエネルギー産生効率を上げている。クリステ形成には、クリステの根元にあたる「クリステジャンクション」を形成するMICOS複合体が必須である。MICOS複合体は外膜のタンパク質と相互作用することで、内膜と外膜が近接する部位(コンタクトサイト)をつくることで、外膜と通過する代謝物質やタンパク質を効率よく内膜に引き渡す機能ももつ。
- MIA経路:ミトコンドリアの膜間部に局在する可溶性タンパク質の多くは分子内にジスルフィド結合をもつ。膜間部のMia40(別名Tim40)は、TOM複合体を介して外膜を通過してきたこれらのタンパク質に結合することで、膜間部への輸送を促進するとともに、基質にジスルフィド結合を導入する。
- ミリストイル化:タンパク質の中には脂肪酸が付加されるものがある。ミリスチン酸(CH3(CH2)12COOH)からミリストイル基が付加されることをミリストイル化と呼ぶ。タンパク質のN端にミリストイル化モチーフがあると、最初のメチオニンが切断された後、2番目のグリシン残基にミリストイル基が付加することが知られている。
- エントロピー:「乱雑さ」を表す物理量。熱力学的には、外部との熱の出入りがなければ、エントロピーが増大する方向に現象は進む。
研究論文情報
「Myristoyl group-aided protein import into the mitochondrial intermembrane space」
(ミリストイル基を介したタンパク質のミトコンドリア膜間部への輸送)
著者(1筆頭著者,2責任著者)
植田依里1(名古屋大学)
阪上春花、河野 慎、角田千香、松本俊介、遠藤斗志也2 (京都産業大学)
田村康 (山形大学)
(ミリストイル基を介したタンパク質のミトコンドリア膜間部への輸送)
著者(1筆頭著者,2責任著者)
植田依里1(名古屋大学)
阪上春花、河野 慎、角田千香、松本俊介、遠藤斗志也2 (京都産業大学)
田村康 (山形大学)
- お問い合わせ先
-
京都産業大学 広報部
〒603‐8555 京都市北区上賀茂本山
Tel.075-705-1411
Fax.075-705-1987
kouhou-bu@star.kyoto-su.ac.jp
