小胞体とミトコンドリア間のコンタクト部位をつくるERMES複合体の構成因子の立体構造と脂質輸送メカニズムを解明
2017.12.26
京都産業大学 総合生命科学部の遠藤斗志也 教授と河野慎 研究員らの研究グループは、小胞体-ミトコンドリア間のコンタクト部位をつくるERMES複合体の構成因子Mdm12の立体構造を解明しました。さらに、Mdm12ともう一つの構成因子Mmm1の複合体(Mmm1-Mdm12)が脂質輸送において重要な役割を果たし、脂質が水に触れることなく小胞体膜からミトコンドリアの外膜へと輸送する仕組みを明らかにしました。
本研究成果は12月26日付けの「Journal of Cell Biology(オンライン版)」に掲載されました。
本研究成果は12月26日付けの「Journal of Cell Biology(オンライン版)」に掲載されました。
背景
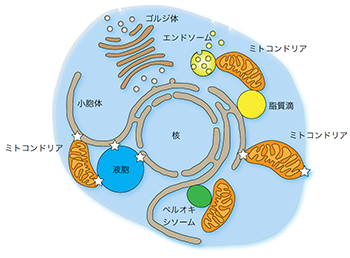
生命活動に必要なエネルギーを産生するなど、ヒトの健康に重要とされるミトコンドリアの機能に必須の特定組成のリン脂質は、水に溶けない性質を持っています。このリン脂質が、水に満たされた細胞内でどのように脂質でできた生体膜から生体膜へと特異的に輸送されるのかという「細胞内の脂質配送」の仕組みについてはほとんど分かっていませんでした。 当研究室ではこれまでに、可溶性の脂質結合タンパク質Ups1-Mdm35複合体が、ミトコンドリア内の外膜と内膜の間を往き来して脂質を運ぶ仕組みを明らかにしましたが、可溶性の脂質結合タンパク質を介さない、全く別の脂質輸送方法があるのではないか、と考えられるようになりました。ヒトをはじめとする真核生物の細胞内は、ミトコンドリア、核、小胞体などのオルガネラ(細胞小器官)と呼ばれる膜構造によって仕切られ、各オルガネラが独自の生化学反応を行うことで、細胞に課せられた複雑な機能を分散管理しています。最近になって、これらのオルガネラ同士は近接し、そこにコンタクト部位とよばれる構造がつくられていることがわかってきましたが、異なるオルガネラ膜間で脂質を直接輸送する仕組みの実験的証拠はありませんでした(図1)。
研究内容・成果
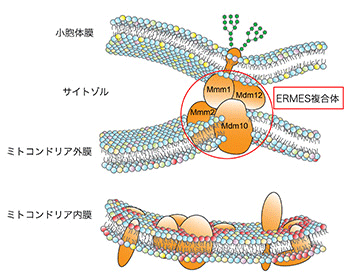
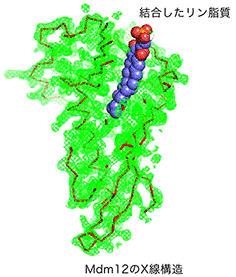
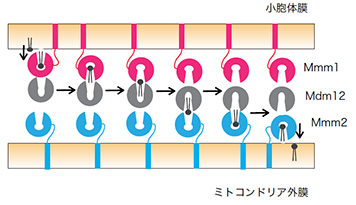
本研究では、酵母で小胞体-ミトコンドリア間コンタクト部位をつくるERMES複合体(以下ERMES)に注目しました。ERMESは、小胞体に局在するMmm1、ミトコンドリアに局在するMmm2とMdm10、両者をつなぐMdm12という4つのタンパク質(サブユニット)で構成されていることが知られています(図2)。このうちMmm1、Mdm10、Mmm2にはSMPドメインという疎水性物質が結合しうる構造の存在がアミノ酸配列から予測されており、脂質結合タンパク質の可能性が考えられていたものの精密構造に関する情報は欠けていました。そこで今回、ERMESを構成するサブユニットのMdm12に着目し、まずは好熱酵母のMdm12を大腸菌に発現させて精製、結晶化を行い、X線構造解析によりMdm12の立体構造を初めて決定しました(図3)。するとMdm12には疎水性の狭いポケットがあり、確かにそこにリン脂質が疎水性の足の部分をポケットの底に向けて突っ込んで結合していることが分かりました。
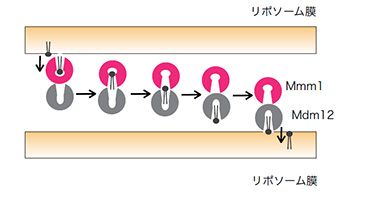
しかし脂質に結合するからといって、生体膜と生体膜の間で脂質を効率よく輸送できるわけではありません。そこで、リポソーム(人工膜小胞)を用いて、試験管内でMdm12が脂質を輸送できるかどうかを調べたところ、輸送活性はほとんどありませんでした。もう一つのサブユニットであるMmm1についても、やはり脂質輸送活性はほとんどありませんでした。ところがMmm1とMdm12が複合体をつくることに気がつき、これらの複合体についてリポソーム間での脂質輸送を調べたところ、今度は高い脂質輸送活性が観察されました。この高い脂質輸送活性はMmm1とMdm12のどちらに強く依存するかを調べるため、構造に基づいて脂質結合ポケットの入り口や底にさまざまな変異を入れてみると、Mdm12に変異を入れてもMmm1に変異を入れても、脂質輸送活性が同程度に下がることがわかりました。このことにより、Mmm1-Mdm12複合体においてはMdm12とMmm1の両方が協調して高い脂質輸送活性を生み出していることが分かりました(図4)。さらにこの結果に基づき、リポソームの代わりに出芽酵母から単離した小胞体とミトコンドリアの膜を用いた、より生理的な環境で脂質輸送活性を測定したところ、Mmm1-Mdm12複合体で同様の高い脂質輸送能が見られました。
この結果は、ERMESのうち、SMPドメインをもつMmm1とMdm12が協調して、脂質を膜から膜へと運べることを示しています。ERMESにはもう一つのSMPドメインを持つサブユニットMmm2が存在します。今回の結果を踏まえると、ERMESでは脂質がMmm1の脂質結合ポケットからMdm12の脂質結合ポケットへ、Mdm12の脂質結合ポケットからMmm2の脂質結合ポケットへと効率よく受け渡されることで、水に触れることなく小胞体膜からミトコンドリアの外膜へと輸送されるモデルを考えることができます(図5)。
以上のことから、ERMESは確かに小胞体とミトコンドリアという2つの膜の間でリン脂質を輸送すること、この輸送活性にはMmm1-Mdm12というコア複合体が重要だということがわかり、オルガネラ間コンタクト部位を介して脂質が運ばれる、具体的な仕組みがはじめて明らかになりました。
脂質輸送機構
リン脂質輸送モデル
今後の展開
今回の結果は、細胞機能に不可欠の脂質の配送を細胞がどのように管制しているか、これまで不明であった細胞内の脂質の配送の全貌と原理を理解しようと研究を進めている当研究室の新しい成果です。小胞体-ミトコンドリア間のコンタクト部位を介した脂質輸送の仕組みが明らかになったことで、細胞内に次々に見つかりつつある他のオルガネラ間コンタクト部位でも、同様に脂質やそのほかの分子が、水の区画を介さずに直接膜から膜へと運ばれていく可能性が考えられます。すなわち、これまで別々に働くと考えられてきたオルガネラが、コンタクト部位を介して脂質をやりとりし、協調して働くという、新しい細胞の働き方の原理発見の突破口となることが期待されます。細胞内の各オルガネラ膜の脂質組成が各々正しく保たれることは細胞機能に必須であり、言い換えれば脂質の組成の異常はミトコンドリアの機能不全をはじめ、さまざまな病態につながります。本研究をきっかけとして、細胞内の各オルガネラ膜が正しい脂質組成に保たれる仕組みの理解、リン脂質供給の異常により引き起こされる疾患の病因の理解や治療法開発への貢献が期待されます。
備考
本研究は、日本学術振興会(JSPS)科学研究費補助金の特別推進研究「ミトコンドリア生合成を司る細胞内統合的ネットワークの解明」、および科学技術振興機構(JST) 戦略的創造研究推進事業 チーム型研究(CREST)の研究領域「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術(研究総括:田中啓二(東京都医学総合研究所 所長))」における研究課題「ミトコンドリアをハブとする構造機能ネットワークの解明」の一環として行われました。
用語・事項の解説
ミトコンドリア
酵母からヒトまで広く真核生物の細胞内に見られる必須のオルガネラ(細胞小器官)。生命活動に必要なエネルギー(ATP)を酸素呼吸によって産生するほか、さまざまな物質の代謝やアポトーシスにも関わる。ミトコンドリアの機能低下や機能異常と老化やがん、糖尿病、さまざまなミトコンドリア病との関連がわかっている。ミトコンドリアの機能を健全に保つことがヒトの健康に重要であることから、健全なミトコンドリアを増やす方法が注目されている。
小胞体
真核生物の細胞内に見られるオルガネラ。細胞から外に出て行くタンパク質の合成、機能獲得、修飾、そして配送の場であるとともに、脂質をはじめ様々な物質の合成代謝、カルシウム貯蔵などに関わる。
ミトコンドリア脂質と生体機能
細胞内の各オルガネラ膜の固有の脂質組成がオルガネラ機能・細胞機能に必須である。ミトコンドリアの内膜にはカルジオリピンとホスファチジルエタノールアミンが多く、このことがミトコンドリア機能に必須である。カルジオリピンは(マウスでは)胚発生に必須であり、その欠損や異常はヒトの老化、心不全、心筋症など、さらには難病として有名なバース症候群につながることが知られている。パーキンソン病との関連を指摘する報告もある。ホスファチジルエタノールアミンはカルジオリピンの機能の一部を代替できると考えられている。
小胞体-ミトコンドリア間 脂質輸送
細胞が必要とするリン脂質の大部分は小胞体膜とミトコンドリア内膜でつくられる。したがってリン脂質の合成中間体は小胞体とミトコンドリアの間を往き来する必要がある。また小胞体とミトコンドリアで合成された脂質は、細胞内の各オルガネラ膜や細胞膜に必要に応じて配送されねばならない。各膜系の脂質組成がどのように監視され、水に溶けない脂質が、何によってどのように、水溶性区画を通って特定の膜に運ばれるのかは、まだよく分かっていない。
オルガネラ間コンタクト部位
これまで細胞内の各オルガネラは物理的に分離し、固有の機能を担うと考えられていたが、近年、異なるオルガネラどうしが一部で物理的に結合していることがわかってきた。この結合部位をオルガネラ間コンタクト部位と呼び、ミトコンドリアと小胞体や液胞、液胞と小胞体や核の間などにコンタクト部位が見つかっている。これらのコンタクト部位の機能はまだよく分かっていないが、脂質をはじめとする様々な代謝物質のオルガネラ間輸送、小胞体やミトコンドリアにおけるカルシウムイオンの貯蔵の制御、オルガネラの分裂の制御に関わることが考えられている。コンタクト部位を構成する因子については最近検索が行われているが、いまのところ出芽酵母の小胞体-ミトコンドリア間のコンタクト部位を形成するERMESの因子同定がもっとも進んでいる。
リポソーム
人工的につくったリン脂質二分子膜の小胞。生体膜のモデル系として利用される。
- お問い合わせ先
-
京都産業大学 広報部
〒603‐8555 京都市北区上賀茂本山
Tel.075-705-1411
Fax.075-705-1987
kouhou-bu@star.kyoto-su.ac.jp
