【Science 掲載】遠藤斗志也教授らがミトコンドリアの膜透過装置TOM複合体の相互作用地図の作成により、タンパク質搬入口として働く仕組みを解明
京都産業大学 総合生命科学部の遠藤斗志也 教授と塩田拓也 日本学術振興会 特別研究員(モナシュ大学・元 遠藤研大学院生)らは、ミトコンドリアの膜透過装置TOM複合体の相互作用地図の作成により、タンパク質搬入口として働く仕組みを解明しました。
本研究成果により、ミトコンドリアへのタンパク質搬入のメカニズムの解明により,ミトコンドリアへのタンパク質配送に関連する病気の治療法の開発や,ミトコンドリアへのタンパク質配送の効率を制御することで老化を防ぐなどの可能性が開けることが期待されます。
本研究成果は,日本時間 2015年9月25日(金)午前3時に米国科学誌「Science」に掲載されました。
研究体制:京都産業大学(前所属:名古屋大学),モナシュ大学,産業技術総合研究所,フライブルグ大学,ストックホルム大学の研究グループの共同研究
掲載論文名
「Molecular architecture of the active mitochondrial protein gate」
(ミトコンドリアへのタンパク質搬入の入口複合体の分子構築)
著者
【1筆頭著者, 2責任著者】:塩田拓也1,神谷恵,遠藤斗志也2(名古屋大学,京都産業大学)塩田拓也1,Victoria L. Hewitt,Khershing Tan,Hsin-Hui Shen,Trevor Lithgow2(オーストラリア・モナシュ大学)今井賢一郎,崎山則征,深沢嘉紀,富井健太郎,Paul Horton(産業技術総合研究所)Jian Qiiu,Nils Wiedemann,Nikolaus Pfanner(ドイツ・フライブルグ大学)Sikander Hayat,Arne Elofsson(スウェーデン・ストックホルム大学)研究概要
ミトコンドリア※1は細胞内で生命活動に必要なエネルギーを産生し,ヒトではその正常機能がヒトの健康につながります。ミトコンドリアの機能低下は老化や様々な病態と関連することが知られています。正常機能のミトコンドリアを維持するためには,ミトコンドリアの外(サイトゾル)からミトコンドリア内にミトコンドリアを構成する1000種におよぶタンパク質を配送する必要があります※2。このミトコンドリアへのタンパク質搬入口として働くのが,複数のタンパク質が組み合わさって出来たTOM複合体※3です。今回研究グループは,TOM複合体でタンパク質の通り道となるTom40と他のタンパク質,およびTOM複合体を通過中の前駆体タンパク質※4との精密な相互作用地図を作成することに成功しました。この相互作用地図から,Tom40がつくる円筒状(βバレル)構造の孔を前駆体タンパク質が通ること,この孔の内側には通過するタンパク質の性質に応じてカスタマイズされた通り道が複数用意されていること,Tom40の孔の出口には,通過してきた前駆体タンパク質を受け取るシャペロンタンパク質※5を集める仕掛けがあることが分かりました。さらにTOM複合体には3分子のTom40から成る孔が3つの完成型(機能複合体)と,2分子のTom40から成る孔が2つの準備型(Tom40組み込み用複合体)という2つの状態があり,それらの状態を往き来することで,常に新しいTom40をTOM複合体に組み込み,正常機能を維持できることが明らかになりました。ミトコンドリアへのタンパク質搬入のメカニズムの解明により,ミトコンドリアへのタンパク質配送に関連する病気の治療法の開発や,ミトコンドリアへのタンパク質配送の効率を制御することで老化を防ぐなどの可能性が開けることが期待されます。
なお,本研究は,科学技術振興機構(JST) 戦略的創造研究推進事業 チーム型研究(CREST)の研究領域「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術(研究総括:田中 啓二(東京都医学総合研究所 所長))」における研究課題「ミトコンドリアをハブとする構造機能ネットワークの解明」の一環として行われました。
背景
ヒトや酵母などの真核生物の細胞内には,ミトコンドリアをはじめとする膜で仕切られた細胞内小器官が存在します。ミトコンドリアは細胞内で生命活動に必須のエネルギー生産を担っており,細胞にとってもヒトの健康にとっても重要な役割を果たしています。ミトコンドリアは外膜と内膜の二枚の生体膜に囲まれ,1000種類以上のタンパク質から構成されていますが,これらのタンパク質のほとんどは,ミトコンドリアの外,すなわちサイトゾルで前駆体として合成されてから,ミトコンドリアの中へ搬入されます(図1)。ミトコンドリアタンパク質前駆体がミトコンドリアに正しく搬入されるのは,前駆体に宛先すなわち「行き先シグナル」が書き込まれているからです。前駆体はミトコンドリア外膜上の受容体によって宛名が読み取られ,トランスロケータ(膜透過装置)が提供する通り道を介することで,通り道なしではタンパク質等の高分子は通過させない外膜を効率よく通過して,ミトコンドリア内に取り込まれます。さらに内部に向かう前駆体は,内膜上の別のトランスロケータや外膜と内膜の間(膜間部)のシャペロンタンパク質の働きによって膜間部,内膜,その内側のマトリックスへと仕分けられ運ばれていきます。外膜のトランスロケータであるTOM複合体は,行き先シグナルの受容体や膜透過用の通り道として働くTom40等のタンパク質から構成され,ほとんどすべてのミトコンドリアタンパク質をミトコンドリア内に取り込む汎用性の高い搬入口として働きます。しかしTOM複合体は高分解能の精密構造がいまだに決定されておらず,各タンパク質がどのように集合して複合体をつくり,各タンパク質がどのように前駆体タンパク質を効率よく外膜透過させるかなどの問題は未解決でした。
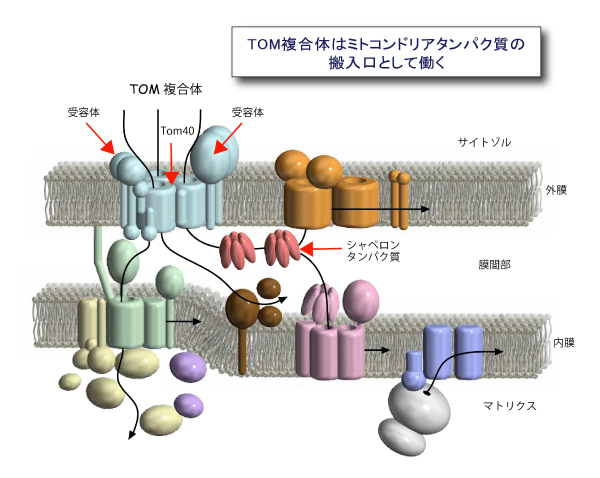
(図1) ミトコンドリアへのタンパク質配送経路と搬入口TOM複合体
1000種類以上のタンパク質のミトコンドリアへの配送経路(黒矢印)。
サイトゾルで合成されたミトコンドリア前駆体タンパク質の大部分は搬入口TOM複合体を通って外膜を通過し,
目的区画に仕分けられる。TOM複合体は受容体や前駆体タンパク質の通り道を提供するTom40から構成される。
研究成果
今回,産業技術総合研究所とストックホルム大学の研究グループは,まずTom40の構造予測を行いました。予測は,構造が似ているミトコンドリア外膜のタンパク質の精密構造を鋳型として,アミノ酸配列の類似性に基づく構造モデリングによって行いました。予測された構造は,これまでの生化学的知見と良く一致しました。次に妥当性が示されたモデル構造に基づいて,Tom40と他のタンパク質との相互作用を調べる目的で,酵母細胞内でTom40の100箇所以上の部位に1つずつ光架橋性非天然アミノ酸のベンゾイルフェニルアラニン(BPA)を導入しました。酵母細胞抽出液や単離したミトコンドリアに紫外線を照射すると,BPAは近傍のタンパク質と光化学反応によって架橋されます。この架橋相手を,抗体を用いて同定することで,Tom40のどの部位がどのようなタンパク質(トランスロケータの構成タンパク質や通過する前駆体タンパク質)の近傍にあるかを,アミノ酸残基レベル(10Å(Åは10-10m)程度)の空間分解能でマッピングする(相互作用地図を作成する)ことが可能となります (図2) 。
TOM複合体の機能に関する大きな論争は,前駆体タンパク質の通り道の実体が何かということでした。膜透過する前駆体タンパク質はTom40の「円筒形βバレル構造の孔」を通るのか,複数のTom40のβバレル構造が集合して作る「分子間の隙間空間」を通るのか,という問題です。今回,前駆体タンパク質の外膜透過反応を停止させてTom40に導入したBPAとの架橋を調べたところ,BPAの反応部位がβバレル構造の内側に向いているときのみ,前駆体タンパク質と架橋されることがわかりました。このことにより前駆体タンパク質は,βバレル構造の孔の内側を通って外膜を透過することがはじめて証明されました。さらに前駆体タンパク質の種類を変えて,Tom40の孔の内側のどの部分と前駆体がコンタクトするかを調べたところ,正に荷電したミトコンドリア行きシグナルをもつ前駆体は,Tom40の孔の内側の負に荷電した部分と接触しながら孔を通り抜け,全体として疎水性の高い前駆体はTom40の孔の内側の疎水性の高い部分と接触しながら通り抜けることがわかりました (図3) 。これは,Tom40がつくる孔は1000種類に及ぶ様々な前駆体タンパク質を効率よく通すために,孔の内側に前駆体タンパク質の性質に応じてカスタマイズされた通り道を複数用意していることを示すものです。
Tom40のポリペプチド鎖のN末端部分はβバレル構造形成には関わりませんが,意外なことにβバレル構造の孔を外(サイトゾル)側から内(膜間部)側に向かって貫き,膜間部のシャペロンタンパク質と相互作用することがわかりました (図4) 。Tom40のN末端部分はシャペロンをβバレル構造の出口にあたる膜間部側に集めることにより,孔を通って膜間部に出てくるタンパク質を効率よくシャペロンに引き渡す働きをすることが明らかになりました。
さらにTOM複合体は,Tom40が3分子集まって孔が3つの三量体複合体を作ること,このとき別のサブユニットのTom22がTom40どうしを集合させる糊の役割を果たしていることがわかりました。この三量体複合体は,糊のTom22が外れることで一部が壊れてTom40が2分子から成る孔2つの二量体複合体に可逆的に変換する,すなわちTom40は二量体と三量体の複合体間を往き来することがわかりました (図5) 。三量体複合体はタンパク質の透過口となるTom40,糊のTom22,そして受容体がすべて集まって,前駆体タンパク質を外膜透過させるために働く完成型(機能複合体)であり,一方二量体複合体は,ミトコンドリアに入ってきた新規Tom40を三量体複合体に組み込むための足場として働く準備型(Tom40組み込み用複合体)です。膜タンパク質複合体が,完成後も構造や構成因子を変えることで,新しいサブユニットを古いサブユニットと入れ替えて,完全な機能をもった複合体を維持していることが,はじめて具体的に証明されました。
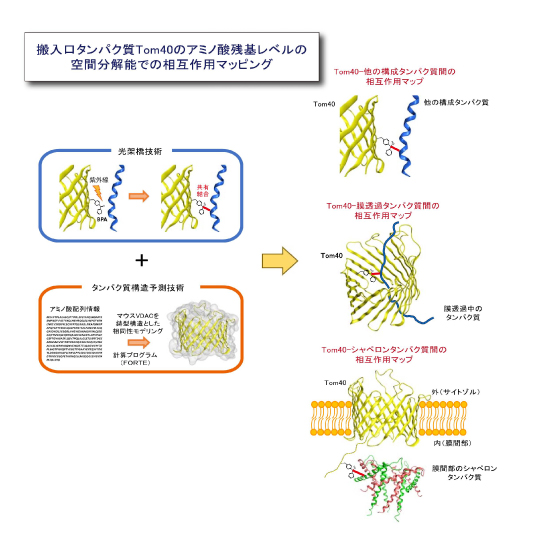
(図2)搬入口タンパク質Tom40の相互作用マッピングの概略
構造予測と光架橋技術を組み合わせて,精密構造解析が困難な膜タンパク質複合体のサブユニット間相互作用,
通過するタンパク質との相互作用,それらの動的変換などを詳細にマッピングできるようになった。
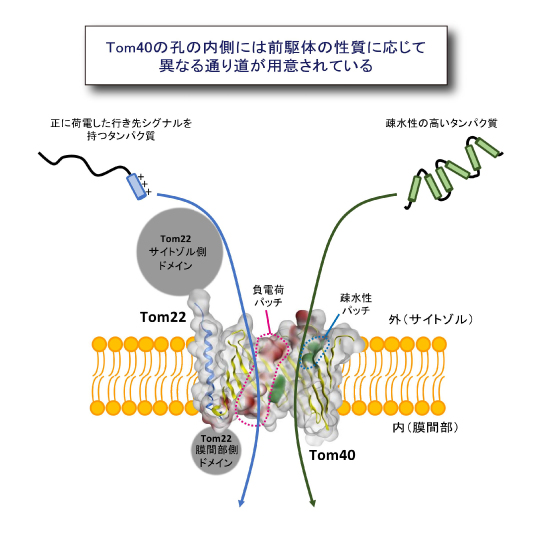
(図3) Tom40の孔の内側は前駆体の性質に応じて異なる通り道が用意されている
前駆体が通るのはTom40の孔の内側であることをはじめて証明した。
さらに孔の内側には前駆体の性質に応じて異なる通り道が用意されていることがわかった。
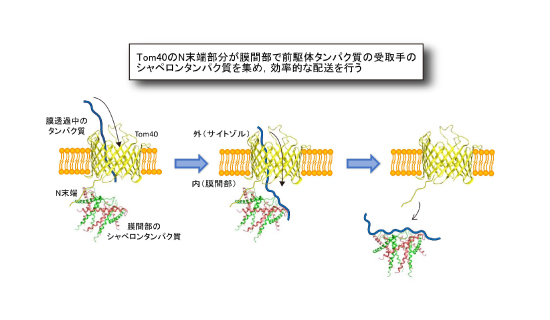
(図4) Tom40のN末端部分はシャペロンを孔の出口に集めることにより,
通過するタンパク質を効率よくシャペロンに引き渡す
Tom40のN末端部分は孔を貫いて反対側の膜間部でシャペロンタンパク質を集める。
このことで孔を通過するタンパク質が効率よく外膜の反対側でシャペロンタンパク質に引き渡されることがわかった。
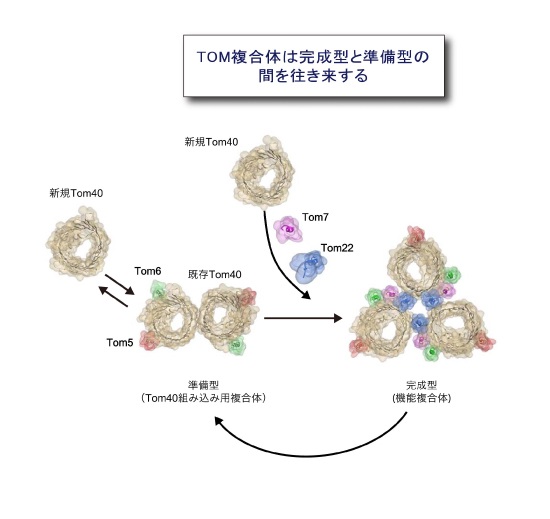
(図5) TOM複合体は孔が3つの完成型と孔が2つの準備型の間を往き来している
TOM複合体はタンパク質を通過させる完成型(機能複合体)と
新しくできたTom40を複合体に組み込むための準備型(Tom40組み込み用複合体)の間を往き来することで,
常に新しいTom40サブユニットを古くなったTom40サブユニットと入れ替えていることがわかった。
今後の展開
本研究で解析した酵母TOM複合体は,ヒト細胞でも同じメカニズムで膜透過装置として働くと考えられています。さらに,本研究で明らかになったTom40の孔の内側に用意されている様々な前駆体タンパク質向けにカスタマイズされた通り道は,ヒト細胞のTom40にも存在することがわかりました。すなわち本研究で明らかになったミトコンドリアへのタンパク質搬入口複合体の働く仕組みは,ヒト等の高等生物における同様のメカニズムの理解に直結し,ミトコンドリアタンパク質の搬入と関連するパーキンソン病などの神経変性疾患や,難病で治療法開発が待たれているミトコンドリア病の病因メカニズム解明に資することが期待されます。将来的には,ミトコンドリアへのタンパク質の取り込み効率の制御により,ミトコンドリア機能や細胞機能を制御することで,未開発だったミトコンドリア病の治療法開発に道筋をつけることや老化の予防に繋がることも期待されます。
用語・事項の解説
1. ミトコンドリア
酵母からヒトまで広く真核生物の細胞内に見られる必須の細胞内小器官。生命活動に必要なエネルギー(ATP)を酸素呼吸によって産生するほか,さまざまな物質の代謝やアポトーシス(細胞死)にも関わる。ミトコンドリアの機能低下や機能異常と老化やがん,糖尿病,さまざまなミトコンドリア病との関連がわかっている。ミトコンドリアの機能を健全に保つことがヒトの健康に重要であることから,異常ミトコンドリアを除去する方法や健全なミトコンドリアを増やす方法が注目されている。
2. タンパク質の配送機構
細胞内で合成されたタンパク質は,働くべき目的地に正しく配送される必要がある。ブローベルらはタンパク質には宅配便のように自分自身に宛名が書き込まれており,それを目的地の装置(トランスロケータの受容体)が読み取る,という原理があることを発見した(1999年ノーベル生理学医学賞)。シェクマンとロスマンは,さらに小胞体からリソゾーム,細胞膜を含む細胞内膜系の間のタンパク質の輸送が小胞を介して行われ,小胞を生み出す膜,小胞,目的地の膜の間でタンパク質の選別の原理が働くことを見出した(2013年ノーベル生理学医学賞)。このようにタンパク質の宛名や選別の仕組みについては理解が進んできたが,トランスロケータがタンパク質をどう膜透過させるのか,などの詳細な仕組みの解明に必須となるトランスロケータの構造については,原核生物等一部の膜系のものについてしか明らかになっていない。
3. TOM複合体
酵母からヒトまで保存されているミトコンドリア外膜のトランスロケータ(膜透過装置)で,ほとんどすべてのミトコンドリアタンパク質のミトコンドリアへの搬入口として働く。ミトコンドリア行きシグナルを認識する受容体,ミトコンドリアンタンパク質前駆体の外膜透過を行うTom40など7〜8種類のサブユニットから構成される膜タンパク質複合体。
4. 前駆体タンパク質
ミトコンドリアタンパク質の大部分はサイトゾルで「前駆体」として合成される。前駆体はミトコンドリア行きシグナルが「プレ配列」としてN末端に付加されたタイプのものと,そうでないものがある。前者はミトコンドリア内でプレ配列が切断されて機能型の「成熟体」となるが,後者はミトコンドリア内で特に配列が変化することなく機能型になる。
5. 膜間部のシャペロンタンパク質
外膜トランスロケータTOM複合体を介して外膜を通過したミトコンドリアタンパク質前駆体は,直接内膜のトランスロケータに引き渡されるか,水溶液区画である外膜と内膜の間の膜間部を通って次のトランスロケータに引き渡されるか,のいずれかの経路に仕分けられる。後者の場合,疎水性の前駆体タンパク質が水溶性区画の膜間部を凝集したりすることなく移動するために,膜間部で疎水性前駆体タンパク質をエスコートする「シャペロンタンパク質」の助けを借りることになる。これらのシャペロンタンパク質は前駆体タンパク質の疎水性部分(水に溶けにくい部分)に結合することで,タンパク質の凝集を防ぐ働きがある。また,これらのシャペロンの機能欠陥が引き起こす聴覚障害(Mohr-Tranebjaerg症候群)が知られている。

