近藤寿人教授らが、ERATOプロジェクトを発展させた国際共同研究により、組織の形態形成の新たな制御機構を解明
総合生命科学部近藤寿人教授によるERATO近藤プロジェクトの研究を発展させた、バース大学、オーストリアIST、東京医科歯科大学などによる国際共同研究で、発生生物学に新しい展開がもたらされました。組織の形態形成に欠かせない新しい調節機構を見つけて、その詳細を解明したのです。メダカの変異体hirameは、メダカ胚自身が持つわずかな重さだけで胚全体が平べったく潰れてしまうほど、組織の形態を維持する力が欠けています。hirame変異体では、YAPというHippoシグナルの制御タンパク質が失われ、YAPによって促進されるはずのARHGAP18という因子の合成が止まり、その結果として、細胞表層のF-アクチンが過剰に形成されてアクチン束が異常になっていました。このことに起因して、①組織に張力がうまれない、②細胞間の相互作用に必要なファイブロネクチンの重合が異常になる、という2つの障害が生じてhirame変異体の表現型がもたらされることがわかりました。Hippoシグナルは現在、形態形成の主要な制御シグナルとしてクローズアップされているもので、幹細胞から組織を構築する場合にも、その作用が必要です。本研究は、Hippoシグナルの新しい作用機構を解明したものでした。
本研究成果は、2015年5月14日刊行の英国雑誌「Nature」に掲載されました。
掲載論文名
「YAP is essential for tissue tension to ensure vertebrate 3D body shape」 (YAPの作用は、組織に張力を発生させて、脊椎動物の体の3次元構造を保つのに必要である)
著者
Sean Porazinski (バース大学) 、Huija Wang (バース大学) 、浅岡 洋一 (東京医科歯科大学) 、 Martin Behrndt ( Institute of Science and Technology Austria ) 、宮本達雄 (広島大学) 、Hitoshi Morita (IST Austria) , 畠星治 (東京医科歯科大学) 。佐々木貴史 (慶応大学) 、S. F. Gabriel Krens (IST Austria) 、長田優美 (ERATO近藤プロジェクト) 、浅香聡 (東京医科歯科大学) 、桃井章裕 (ERATO近藤プロジェクト) 、Sarah Linton (バース大学) 、Joel B. Miesfeld (ウイスコンシン大) 、Brian A. Link (ウイスコンシン大) 、千賀威 (名古屋大学) 、Atahualpa Castillo-Morales (バース大学) 、Araxi O. Urrutia (バース大学) 、清水信義 (慶応大学) 、Hideaki Nagase (オックスフォード大、松浦伸也 (広島大学) 、Stefan Bagby (バース大学) 、近藤寿人 (京産大、ERATO近藤プロジェクト) 、仁科博史 (東京医科歯科大学) 、Carl-Philipp Heisenberg (IST Austria) 、古谷-清木 誠 (バース大学、ERATO近藤プロジェクト)研究概要
背景
近藤寿人総合生命科学部教授は、1999年から2007年まで、JST(科学技術振興機構)によるERATO「近藤誘導分化プロジェクト」ならびにその発展事業を、近畿地方発明センター(現 京都技術科学センター)で実施しました。
http://www.jst.go.jp/erato/research_area/completed/kyb_PJ.html
http://www.cc.kyoto-su.ac.jp/~yishii/devbiol/_src/sc914/how_a_life_forms_reduced_quality.mp4
その事業の中心であったのは、日本産メダカを用いて胚発生が異常になる変異体を多数作り出して、それらを系統的に解析すること、そして変異体の異常の原因を手がかりとして、発生に関わる未知の制御機構を明らかにすることでした。その事業で単離されたメダカ変異体の研究から、すでに沢山の成果が得られています。その中でも特筆すべきhirame変異体は、メダカ胚自身が持つわずかな重さだけで胚全体が平べったく潰れてしまうという、独特の異常(表現型)を持ったもので、その原因遺伝子から表現型に至るまでの一続きの制御機構が詳細に調べられました。(図1)
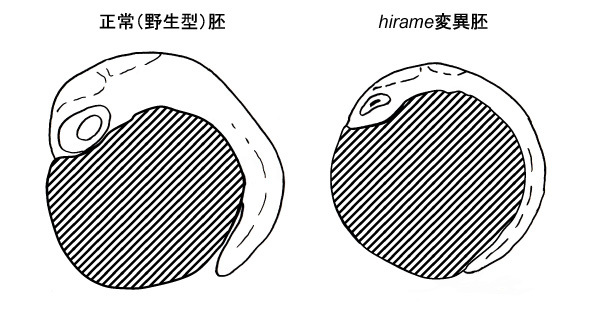
(図1) 同じ発生時期の、メダカ正常胚とhirame変異胚を、胚の横から見たスケッチで比較した。
hirame変異体では、胚全体の組織が扁平につぶれている。斜線部は卵黄。
研究結果
現在、Hippoシグナルが、発生の形態形成を調節するために重要なシグナル機構として、脚光を浴びています。その中心となるのはYAP(Yes-associated protein)というタンパク質因子です。Hippoシグナルが作用しない状態では、YAPは細胞の核の中に入って、TEADという転写因子を活性化しますが、Hippoシグナルが作用するとリン酸化されてその作用を失います。このHippoシグナルは、細胞間の接触の違いによって影響を受けたり、細胞から分泌されるさまざまのシグナルタンパク質の作用の影響を受けたりすることによって、形態形成を伴った組織形成の過程で、細胞極性の調節、細胞増殖の調節、細胞死の調節など、さまざまな調節機構を統合するという重要な役割を果たしています。
メダカのhirame変異体の原因遺伝子を、メダカの全ゲノム配列と、Snips (メダカ系統間での、局所的な塩基配列の違い)を手がかりにして、ゲノム配列上の部位として明らかにしたところ、メダカのYap遺伝子にナンセンス変異が起きており、YAP因子が全く作られないことがわかりました。しかし、胚がつぶれてしまうというhirame変異体の表現型は、それまでのHippoシグナルの理解ではうまく説明できませんでした。逆に言えば、hirame変異体の表現型をYAP機能の喪失から始まった一つの連鎖反応として説明できれば、Hippoシグナルが関与する、新しい調節機構を明らかにしたことになるでしょう。この観点から、hirame変異体の研究を進めるとともに、人の色素網膜細胞株の集合体を用いて、YAPの作用を解析しました。この細胞でもYAPの発現を低下させるとhirame変異体と同様に、組織の張力が低下したからです。
YAPタンパク質が失われると数10の遺伝子の発現が低下することがわかりました。それらの遺伝子がコードするタンパク質の中で、最近発見されたARHGAP18という因子(RhoGTPase)に注目しました。この因子には、細胞表層でF-アクチンの形成を調節する作用があるからです。実際、hirame変異体にARHGAP18を強制発現すると、hirame変異体のさまざまな異常が回復しました。
では、ARHGAP18は何をしているのでしょうか?ARHGAP18はRho因子を不活性化し、そのことによってF-アクチンの形成にブレーキをかけて、F-アクチンが過剰になるのを防ぎます。その結果、細胞表層に適度に重合したアクトミオシンの束が形成され、①細胞間接着を介して組織に張力を生み出します。また、②ファイブロネクチンの重合を調節して、ファイブロネクチンを介した細胞間の相互作用を活性化します。(図2)つまり、これらの2つの効果を生むことがわかりました。hirame変異体ではARHGAP18の発現が低下する結果、F-アクチンが過剰に形成されてしまい、さきの2つの作用のいずれもがだめになっていたのです。
本研究によって、現在注目を集めているHippoシグナルの新しい作用とその詳細な作用機構が明らかになりました。胚発生で起きる形態形成を理解したり、幹細胞からの臓器構築をデザインしたりする際に、重要な指針を与える発見です。
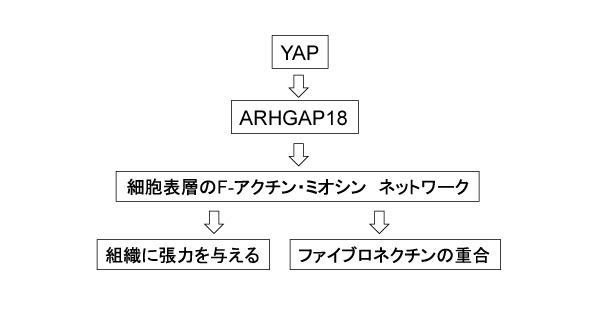
(図2) Hippoシグナルの新しい細胞調節の経路

