津下英明教授のグループがRhoA特異的ADPリボシル化酵素C3とRhoA複合体の結晶構造解析に成功
RhoA特異的ADPリボシル化酵素C3の基質認識機構と反応機構の解明のため、C3と基質タンパク質RhoAとの複合体の構造の解明が望まれていました。同グループではアクチンを特異的にADPリボシル化する酵素Iaとアクチン複合体の結晶構造解析に引き続き、全く異なる基質特異性を持つADPリボシル化酵素C3と基質RhoAとの複合体の構造を明らかにしました。
論文情報
“Rho GTPase Recognition by C3 Exoenzyme Based on C3-RhoA Complex Structure.”
J Biol Chem. 2015 Jun 11. pii: jbc.M115.653220.
概要
京都産業大学・総合生命科学部 兼 構造生物学研究センターの津下英明教授の研究グループが、RhoA特異的ADPリボシル化酵素C3とその基質であるRhoAとの複合体の結晶構造解析に成功し、Journal of Biological Chemistryへ発表しました(電子版 6月11日)。本論文は、生命資源環境学科の平成26年度の卒業生 戸田暁之さんの卒業研究を中心にまとめたものです。
RhoA特異的ADPリボシル化酵素C3はRhoAのAsn41を特異的にADPリボシル化*1する酵素であり、1989年に見出されました。代表的なRhoファミリー分子にはRhoA, Rac1, Cdc42がありますが、C3はRhoAのみをADPリボシル化します。この特異性を利用して、Alan Hall (メモリアルスローンケタリングがんセンター)らは、RhoAがストレスファイバーと接着斑を、Rac1が葉状仮足を、Cdc42が糸状仮足を、それぞれ誘導することを見出しました。こういった生物学的に重要な知見をもたらしたC3のRhoAに対する特異性に、RhoAの研究者を含む多くの研究グループが興味を抱いてきました。しかしながら、C3とRhoAの複合体の構造が明らかではないために、その相互作用とADPリボシル化の機構はよくわかっていませんでした。
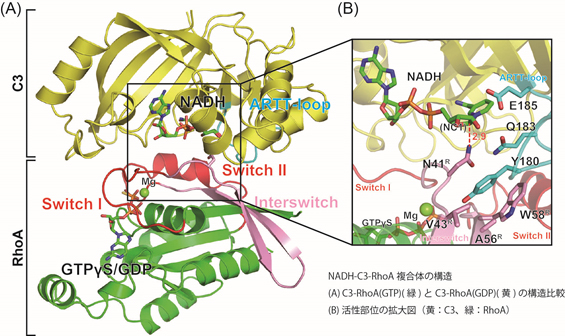
同グループはセレウス菌由来のC3を用いて、GTPが結合したRhoA(RhoA(GTP))とC3の複合体および、GDPが結合したRhoA(RhoA(GDP))とC3の複合体の結晶化に初めて成功しました。さらに、これらの結晶をNADHを含む溶液にソーキング*2した後にX線回折データを収集することで、NADH、RhoA、C3の3者複合体の結晶構造(NADH-C3-RhoA(GTP)とNADH-C3-RhoA(GDP))を明らかにしました(図A)。
C3と複合体を形成していない時、RhoAの2つの領域 (switch Iとswitch II)は、GTPが結合しているかGDPが結合しているかによって異なる形状(コンフォメーション)を取り、そのコンフォメーションの変化がシグナル伝達のスイッチとなることが知られています。面白いことに、今回明らかにしたNADH-C3-RhoA(GTP)とNADH-C3-RhoA(GDP)の構造では、結合しているヌクレオチド(GTPあるいはGDP)が異なるにもかかわらず、RhoAのswitch領域はどちらも同じコンフォメーションであり、switch IはGDPが結合したRhoAと同じコンフォメーションを、switch IIはGTPが結合したRhoAと同じコンフォメーションを、それぞれとっていました(図A)。このことはC3がRhoA(GTP)もRhoA(GDP)も基質とすることを良く説明します。また、これまでの研究や今回明らかにした構造をもとに、C3によるRhoAの特異的な認識に重要なアミノ酸を特定しました。つまり、これらのアミノ酸の違いにより、RhoA、Rac1、Cdc42がC3の基質となり得るかどうかが決まるのではないかと考えました。期待通り、着目したいくつかのアミノ酸に変異を持つRhoA変異体は、C3によるADPリボシル化活性が減少しました。また逆に、着目した4つのアミノ酸をRhoAのアミノ酸に置換したCdc42の変異体は、C3によるADPリボシル化活性を示しました。
これまでのC3単体の構造解析からARTT-loop(ADPリボシル化毒素turn turn-loop)が基質RhoAの認識に重要であるとの仮説が出されていました。しかしながら、その相互作用を直接示す実験結果はありませんでした。今回明らかにした複合体の結晶構造は、C3によるARTT-loopを介したRhoAの認識機構を初めて直接示しています。また、C3のGln183、RhoAのAsn41、NADのNC1原子、これら3原子の位置関係は、C3酵素と基質RhoAとの結合が、ADPリボシル化反応に最適な構造(環境)を生み出していることを示唆しています(図B)。
以前から同グループでは、アクチンのアルギニンを特異的にADPリボシル化する酵素Iaとアクチン複合体の結晶構造解析に取り組み、その特異性や反応機構を明らかにしてきました。今回明らかにした複合体は、同じくADPリボシル化を触媒する酵素(C3)ですが、異なる基質(RhoA)を認識し、アスパラギンをADPリボシル化します。非常に似た構造をした酵素(IaとC3)が、異なる基質を認識し、異なるアミノ酸をADPリボシル化する仕組みが、これらの複合体を比較することで、今後明らかになることが期待されます。
この研究は、生命資源環境学科の4年生、戸田暁之さんによって行われた卒業研究を中心にまとめたものです。学部4年生での研究成果が、Journal of Biological Chemistryに採用されたことは、京都産業大学の教育研究の成果であり、大変意義のあることだと言えます。
戸田暁之さん(現在大阪大学/博士前期課程1年)は「1年半の間行った研究の成果が、Journal of Biological Chemistryに採用されたことは、非常に嬉しく思います。この成果が得られたのも、津下英明教授をはじめ、津下研究室の皆様のお力があってこそと、心より感謝申し上げます。実際に、得られた複合体の結晶構造から、分子の作用機構が明らかになることに感激しました。このような最前線の研究を行った経験を、今後の研究生活に活かし、さらに邁進していきたいと思います。」と語っています。
京都産業大学、総合生命科学部、津下研究室では、今後も、フロンティアとなるような研究を目指して、学生と共に構造生物学の研究を行っていきたいと考えています。
本研究は、文部科学省科学研究費 基盤研究C「ADPリボシル化酵素C3のRhoGTPase認識機構の解明」(15K08289)新学術領域研究(研究領域提案型)細胞シグナリング複合体によるシグナル検知・伝達・応答の構造的基盤「複合体構造解析による細菌毒素の標的結合タンパク質認識機構の解明」(25121733)および私立大学戦略的研究基盤形成支援事業「タンパク質の生成と管理」の支援を受けました。
*1 ADPリボシル化:翻訳後修飾の一つ。NAD+からADP部分を切り取り対象のタンパク質に付与する反応である。
*2 ソーキング:浸漬の意。生成したタンパク結晶を基質化合物の溶液に浸漬することで結晶内の活性部位に基質化合物を結合させることを目的として行う。

