京都産業大学 総合生命科学部 永田和宏 教授らの研究グループが
モヤモヤ病の発症に関わるタンパク質ミステリンの構造を解明
総合生命科学部の永田和宏教授、森戸大介研究員らのグループは、名古屋大学(藤吉好則教授)、北海道大学(金城政孝教授、北村朗助教)、京都大学(寳関淳准教授)などと共同で、モヤモヤ病関連タンパク質ミステリンが細胞内でドーナツ状の巨大分子複合体を形成し、細胞内のエネルギー通貨であるATPのエネルギーを使いながら、細胞内の巨大分子エンジンとしてはたらくことを明らかにしました。
本研究の成果は2014年3月24日付で英国の科学雑誌Scientific Reportsに掲載されました。
掲載論文名
Moyamoya disease-associated protein mysterin/RNF213 is a novel AAA+ ATPase, which dynamically changes its oligomeric state
(モヤモヤ病関連タンパク質ミステリン/RNF213は新規のAAA+ ATPアーゼであり、ダイナミックに複合体状態を変化させる)
著者
森戸 大介(京都産業大学)、西川 幸希(名古屋大学)、寳関 淳(京都大学)、北村 朗(北海道大学)、小谷 友理(京都産業大学)、木曽 和美(京都産業大学)、金城 政孝(北海道大学)、藤吉 好則(名古屋大学)、永田 和宏*(京都産業大学) (*責任著者)
研究概要
モヤモヤ病は日本を初めとする東アジア地域で多く見られる疾患で、脳血管の狭窄による脳血流低下と脳出血を特徴としています。1957年に我が国で初めて発見されて以来、50年以上が経過していますが、発症の原因・メカニズムについてはほとんど不明のままでした。2011年、我々は京都大学(小泉昭夫教授)、国立循環器病センター(橋本信夫総長)、大阪大学(高島成二教授)などと共同でモヤモヤ病の発症リスクに著明に関わる遺伝子を発見し、クローニングしました(RNF213)。RNF213はこれまで知られていない新規の遺伝子であり、モデル生物であるゼブラフィッシュの血管形成に必須の因子であることが確かめられましたが、その具体的な細胞内活性や機能について全く不明のままでした。RNF213の機能解明がモヤモヤ病の発症機序の解明に結びつくことが強く期待されたため、その後も解析を継続し、今回、この遺伝子にコードされるタンパク質はAAA+ ATPアーゼと呼ばれる酵素の仲間であることをつきとめ、ミステリンと名付けました。ミステリンは細胞内でドーナツ状の巨大複合体を形成して、細胞内のエネルギー通貨であるATPのエネルギーを使ってはたらく、巨大なタンパク質エンジンであると考えられました(図1、図2)。今後ミステリンがタンパク質エンジンとして、細胞内でどのような物理的作業をしているのかを解明することにより、ミステリンの生理機能およびモヤモヤ病の発症機序が明らかになることが期待されます。
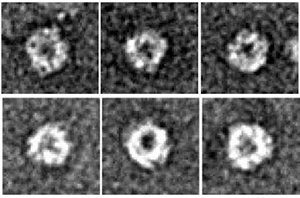
図1 ミステリンタンパク質のドーナツ状構造
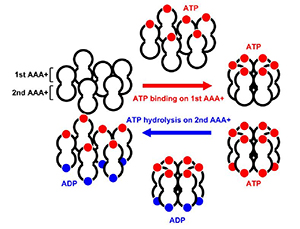
図2 ミステリンの複合体形成サークル
ミステリンは2つあるAAA+ATPアーゼ構造のうち、1つめのAAA+ATPアーゼ構造でATP(赤丸)と結合すると、集合してドーナツ状構造を形成し、2つめのATPアーゼ構造でATPをADP(青丸)に分解すると、解離してスタンバイ状態に戻る。

