総合生命科学部、構造生物学研究センターの津下教授と鶴村プロジェクト助教等の発見が米国科学アカデミー紀要(PNAS)のオンライン版に掲載
2013年2月4日(米国東部時間 午後3時)に米国の科学雑誌Proceeding of the National Academy of Science (PNAS)のオンライン版に、総合生命科学部および構造生物学研究センターの 津下教授と鶴村プロジェクト助教等の「イオタ毒素−アクチン複合体結晶構造解析から示唆されるアルギニンADPリボシル化の反応機構」に関する論文が掲載されました。
掲載論文名
"Arginine ADP-ribosylation Mechanism Based on Structural Snapshots of Iota-toxin and Actin Complex"
イオタ毒素−アクチン複合体結晶構造解析から示唆されるアルギニンADPリボシル化の反応機構
Proceeding of the National Academy of Science (PNAS)
著者
鶴村俊治(京都産業大学)、津守耶良(京都産業大学)、秋こう(京都産業大学)、小田真隆(徳島文理大学)、櫻井純(徳島文理大学)、永浜政博(徳島文理大学)、津下英明(京都産業大学)
研究内容の概要
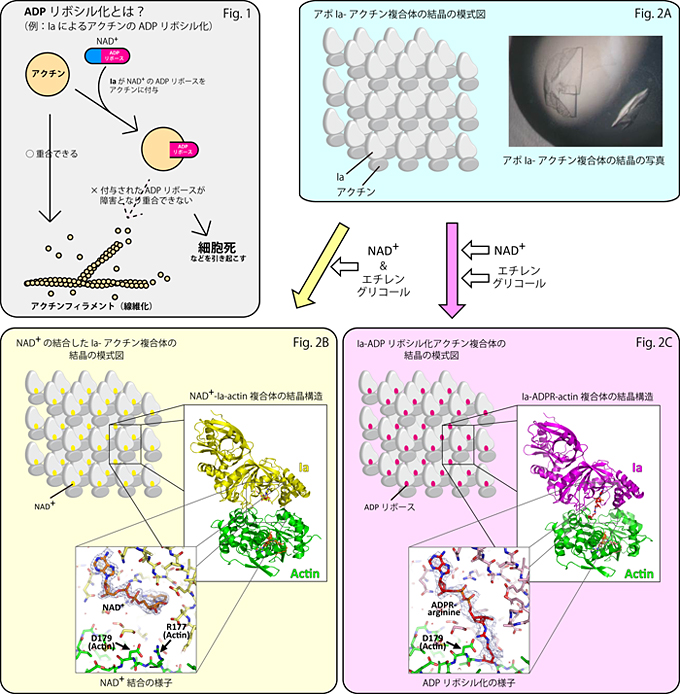
毒素であるIaは食中毒を引き起こすウェルシュ菌から分泌され、NAD+の一部であるADPリボースを切り取りヒトのアクチンに付与します。ADPリボースを付加する反応をモノADPリボシル化といいます注1。アクチンがモノADPリボシル化されることにより細胞は正常な形を維持することができなくなります。その結果、細胞死に至り、下痢などの症状を引き起こします(Fig. 1)。このモノADPリボシル化の反応機構を知るためには、毒素であるIaと基質タンパク質であるアクチンの複合体の構造を知る事が重要です。現在まで、NAD+に類似した非水解性の化合物βTADを用いたβTAD-Ia-actinの結晶構造のみが知られていましたが(Tsuge et al. PNAS 2008)、本来の基質であるNAD+結合型および反応後のモノADPリボシル化された構造については解明されていませんでした。今回、アポ注2Ia-actinの結晶を作製し(Fig. 2A)、この結晶を異なった手順でNAD+溶液に浸漬することでNAD+の結合したIa-actin複合体(Fig. 2B)と、IaとモノADPリボシル化されたactin複合体(Fig. 2C)の二つの結晶構造を高い分解能で明らかにしました。この二つの構造は、モノADPリボシル化反応の前と後の状態であり、その反応機構は我々が以前に提唱したstrain-alleviation model (緊張と緩和モデル)をさらに、裏づける結果となりました。
背景
モノADPリボシル化毒素は、細菌から分泌され、その基質タンパク質とアミノ酸の特異性からいくつかの種類が知られています。例えば、これら毒素の一つは、ヘテロメリックのGタンパクをモノADPリボシル化し、通常の生体反応に必要なシグナル応答をかく乱して脱水症状を引き起こします。ウェルシュ菌由来の二成分毒素であるIota毒素は、膜に結合する“Ib”とモノADPリボシル化酵素である“Ia”から構成されています。Ibが細胞膜に結合しIaを細胞内に送り込むことを役目とし、Iaは細胞内のアクチンを標的としてモノADPリボシルを起こします(Fig. 1)。この種類の毒素はいくつか知られており、アクチンの177番目のアルギニンをモノADPリボシル化する事でアクチンの重合(線維化)を阻害し、細胞の形状維持を妨げるなどの細胞毒性を示すことが知られています。ボツリヌス菌のC2Iやサルモネラ菌のSpvBも同じ活性を持ち、我々のグループを含め世界中の様々なグループが、その毒素単体の結晶構造を明らかにし、その機能を探ってきました。我々はさらにその機能を理解するために、Iaとアクチンの複合体の結晶構造を非水解性のNAD+類似化合物のβTADとともに明らかにしました(Tsuge et al. PNAS 2008)。しかしながら、本来の基質であるNAD+が結合した状態やモノADPリボシル化反応後の構造はわかっていませんでした。本研究では、モノADPリボシル化の反応前と反応後の複合体の姿をX線結晶構造解析注3でとらえ、その反応機構を明らかにする事を試みました。
内容
今回我々は、まずアポIa-アクチン複合体の大きな結晶の作製に成功しました(Fig. 2A)。また、結晶を凍結させるべく使用した、エチレングリコールを含んだ母液注4がモノADPリボシル化反応を抑える事を見いだしました。本来の基質であるNAD+とエチレングリコールを含んだ母液に結晶を浸漬することで、反応前(NAD+は結合するが反応は起きない)の状態で結晶を凍結し、この状態で回折データを収集しました(Fig. 2B左)。一方、別の結晶を用いて、NAD+を含みエチレングリコールを含まない母液に結晶を浸漬してモノADPリボシル化反応を進行させた状態で、結晶を凍結して回折データを収集しました(Fig. 2C左)。これら2つのデータからそれぞれ、反応前であるNAD+-Ia-actin複合体(NAD+結合型、Fig. 2B右、下)と反応後のIa-ADPribosylated(ADPR)-actin複合体(ADPリボシル化型、Fig. 2C右、下)の結晶構造を高い分解能で明らかにしました(1.7 Å および2.2 Å)。また、反応に重要なアミノ酸E378とE380の点変異体を作り、このNAD+-Ia(mutant)-actinでの結晶構造も明らかにしました。
複合体の結晶構造がわかったことにより、モノADPリボシル化の反応機構を推察できます。まずNAD+からSn1反応により、ニコチンアミドが切れ、オキソカルベニウムカチオン中間体ができます。さらに第2のオキソカルベニウムカチオン中間体を経て、アクチンのアルギニン177に近づき、ADPリボシル化の修飾反応が起きると考えられます。オキソカルベニウムカチオンの第一から第二の中間体の構造変化は、ADP部分をIaにつかまれた状態で起こることが一連の構造から示唆されました。我々はオキソカルベニウムカチオンの第一中間体では構造的緊張(strain)した状態であり、これが緩和(alleviation)する事により構造変化が起こる事を提唱し、strain-alleviation model と呼びました。同様のADPリボシル化反応機構は、アクチンを標的とした毒素以外でも様々なシグナル応答に関与するRhoAを標的とした毒素C3や、さらにはヒトのモノADPリボシル化酵素およびDNA切断修復に関与するポリADPリボシル化酵素(PARP)でも見られると考えています。
今後の展開
毒素単体でなく基質タンパクおよびNAD+との複合体は、その反応機構や阻害剤のデザインにも重要な知見を与える事が予想されます。
本研究は文部科学省 戦略的基盤研究支援事業「タンパク質の生成と管理」 および 新学術領域研究「細胞シグナリング複合体によるシグナル検知・伝達・応答の構造的基礎」の支援を受け、徳島文理大学 薬学部 永浜政博教授、小田真隆講師との共同研究で行われました。これらデータは大学共同利用機関法人高エネルギー加速器研究機構のビームラインで収集されました。
注1 ADPリボシル化:NAD+を用いた翻訳後修飾のひとつ、Fig. 1参照
注2 アポ:タンパク質に基質やコファクター等が結合していない状態
注3 X線結晶構造解析:塩などと同様にタンパク質も結晶となることを利用し、作製した結晶にX線を照射し、そこから得られたデータをもとにタンパク質の構造を解析する手法、分野
注4 母液:タンパク質結晶を作製するための沈殿剤、緩衝液等が入った溶液