総合生命科学部および構造生物学研究センターの伊藤教授と千葉助教の
グループの発見が米国の科学雑誌Molecular Cellのオンライン版に掲載
2012年8月2日(米国東部時間)に米国の科学雑誌Molecular Cell (Cell Press発刊) のオンライン版に、総合生命科学部および構造生物学研究センターの 伊藤教授と千葉助教のグループの「タンパク質合成のスピード調節に関する新たな様式の発見」が掲載されました。
掲載論文名
Multisite Ribosomal Stalling: A Unique Mode of Regulatory Nascent Chain Action Revealed for MifM
(マルチサイト翻訳アレスト:MifMの解析から明らかになった翻訳途上鎖のユニークな翻訳アレスト様式)
著者:千葉志信(京都産業大学)、伊藤維昭(京都産業大学)
研究内容の概要
細胞がタンパク質を合成するときのスピード制御という基本的な過程について、新たな方式を発見した研究です。タンパク質合成(遺伝情報のアミノ酸配列への翻訳)は速やかに、かつ正確に進行する必要があります。一方で、タンパク質の鎖を合成していく時に、鎖の伸長速度を減速させることによって細胞の機能を調節する仕組みがあることも明らかにされてきています。中には、合成されつつあるタンパク質が、翻訳装置であるリボソームに働きかけ、自身の翻訳の進行を停止(アレスト)させる興味深い例も知られています。このような機構で翻訳アレストを起こすものは、通常、合成途上鎖のある特定の1カ所でしか翻訳アレストを起こすことができないと考えられておりました。 今回私たちは、枯草菌のアレスト因子MifMが、複数の連続したコドンで翻訳アレストを起こすことを見出し、マルチサイト・アレストと命名しました。翻訳アレストの継続時間はアレスト因子による細胞機能調節の効果を左右する重要な要素の一つですが、MifMによるマルチサイト・アレストは、複数回の翻訳アレストを足し合わせることで全体としてアレスト継続時間を稼ぐための巧妙な仕組みであることを提唱しました。
背景
タンパク質合成装置であるリボソームは、メッセンジャーRNA(mRNA)上を移動しながらそこに記載された遺伝情報(タンパク質の設計図)を解読しつつ、その情報に基づく正確な順番でアミノ酸を一つずつ繋げて行きます。このペプチド転移という反応を繰り返してポリペプチド鎖を伸長し、タンパク質を合成します。合成途上のポリペプチド鎖は、リボソームにある専用のトンネルを通過し、リボソームの外へと導かれます。全長の合成が完了すると、タンパク質はリボソームから遊離し、細胞質へと放出されます。「翻訳」と呼ばれるこのプロセスは、正確かつ速やかに進行することが大切ですが、一方で、翻訳の進行速度は必ずしも一定ではなく、場合によってはリボソームがmRNA上で立ち止まる(アレストする)ことが、タンパク質の正しい局在化や構造形成、遺伝子発現調節などに寄与する例が見つかってきています。中には、合成されつつある新生鎖が、リボソームのトンネル成分と相互作用することで自身の翻訳伸長速度を調節する例も見出されています。
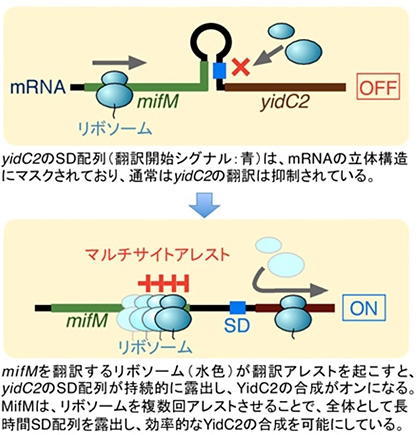
私たちが以前見出した枯草菌MifMは、自身の翻訳をアレストさせることでYidC2と呼ばれるタンパク質の合成を促進するユニークな因子です。枯草菌は、タンパク質の膜組込チャネル(タンパク質を膜に挿入して膜タンパク質を作るための経路)として働く装置として、SpoIIIJとYidC2の二つのYidCファミリー膜タンパク質を持っています。通常はSpoIIIJが多く発現しており、YidC2はほとんど発現していませんが、SpoIIIJの活性が低下し、細胞の膜組込能力が低下すると、それを補うピンチヒッターとしてYidC2が合成されます。MifMとYidC2は、同じ1本のmRNA上から翻訳されてできてきます。MifMの翻訳が途中で停止すると、mRNA上で停止したリボソームがmRNAの構造を変化させて、隠されていたYidC2の翻訳開始シグナルを露出させます。この露出がYidC2合成のスイッチをオンにします。MifMの翻訳アレストが長時間続けば、それだけ多くのYidC2が合成されることになります。MifMの翻訳アレストは、MifMがSpoIIIJによって膜に組み込まれると解除されます(MifM自身も膜タンパク質です)。したがって、SpoIIIJの働きが十分なときは、MifMは翻訳アレストを起こさず、YidC2合成のスイッチはオフになり、一方、SpoIIIJの働きが不充分なときには、MifMが翻訳アレストを起こしてYidC2合成のスイッチをオンにします。
内容
MifMのような翻訳アレスト因子は、リボソームにおいてある特定のアミノ酸配列(アレストモチーフ)が合成され、それがリボソームのトンネル内のしかるべき場所に位置したときにのみリボソームと特異的な相互作用を起こして翻訳を停止さると考えられてきました。新生ポリペプチド鎖はトンネル内を一方向に動いてゆくので、アレストモチーフがリボソームの活性中心部位やトンネル内の特定の相互作用部位と結合できる機会は1本の鎖の合成過程において一度しか訪れません。実際に、これまで解析されている翻訳アレスト因子は、いずれも、翻訳アレストを一カ所でしか起こすことが出来ません。新生ポリペプチド鎖のある特定の配列とリボソームトンネル成分は一期一会の関係にあると言えます。
しかし、今回私たちは、独自に構築した試験管内翻訳反応系を利用し、Toeprint実験と呼ばれる手法などを用いることで、MifMが、連続した複数のコドンで順次翻訳アレストを起こすことを見出しました。また、MifM配列中の新たなアレストモチーフとして負電荷アミノ酸のクラスターを見いだしました。変異解析を行ったところ、このエレメントが、アミノ酸配列に依存せず、静電気的性質にのみ依存して翻訳アレストを起こすことが示唆され、このユニークな性質によってマルチサイト・アレストが可能となっていることを提唱しました。また、抗生物質ピューロマイシンを用いた実験などから、この複数のアレストが、リボソームのペプチジル転移活性の阻害によって引き起こされることを示しました。翻訳アレストの持続時間はターゲット遺伝子の発現量を決定する重要な要素の一つですが、MifMは、複数回の翻訳アレストを足し合わせて全体のアレスト継続時間を稼ぐというユニークな戦略によって、YidC2タンパク質が十分量合成されるように調節しているものと考察されます。