- HOME
- What's New - 吉田賢右 研究機構 シニアリサーチフェローらのグループが人間の細胞のエネルギー分子(ATP)を合成する酵素のメカニズムを解明
吉田賢右 研究機構 シニアリサーチフェローらのグループが人間の細胞のエネルギー分子(ATP)を合成する酵素のメカニズムを解明
本研究の成果は、2014年9月21日付けでNature Chemical Biology のonline版に掲載されました。
掲載論文名
Chemo-mechanical coupling of human mitochondrial F1-ATPase motor
(ヒトのミトコンドリアのF1-ATPアーゼの化学-力学共役)
著者
鈴木俊治*(京都産業大学)、田中一巳(京都産業大学)、若林千晃(ICORP, JST)、税田英一郎(京都産業大学)、吉田賢右*(京都産業大学)(*責任著者)
研究概要
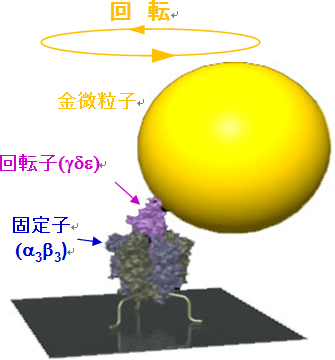
図1
細胞は、エネルギー通貨としてATPという分子を使っています。ATPをADPとリン酸に分解して、その時に発生するエネルギーを使ってあらゆる種類の仕事をしているのです。分解で生じたADPとリン酸からATPを再び合成するのはATP合成酵素です。ATP合成酵素は、回転するモーター酵素であり、細菌では細胞膜にあり、ヒトなどではミトコンドリアにあります。ATP合成酵素は2つの部分に分けることができて、そのうちF1-ATPアーゼはATPの加水分解と合成反応をおこなう触媒部分であり、回転するモーターです。細菌のF1-ATPアーゼの回転はずいぶん前に同じく吉田らのグループによって証明されましたが、ミトコンドリアのF1-ATPアーゼの回転の実証と解析はながらく成功しませんでした。今回、ヒトのミトコンドリアのF1-ATPアーゼをガラス表面に固定し、その回転子に金の微粒子を接着し(図1)、この金微粒子がATPの加水分解によって回転するようすが光学顕微鏡で直視され、1秒間に20万コマという早いカメラで記録されました。解析の結果、ヒトのF1-ATPアーゼは、1秒間に約1400回転の超高速で回転し、1分子のATP当たり120度回転することがわかりました。さらに詳細に観察すると、0度の位置で結合したATPはそれから210度回転した位置で分解され、305度のあたりでリン酸が酵素から離れることがわかりました(図2)。細菌の場合は、分解は200度、リン酸の解離は200度あるいは320度(未定)なので、F1-ATPアーゼは細菌からヒトへの進化の過程で、その仕組みを少し変えています。ヒトの場合にはIF1というタンパク質がミトコンドリアの中にあって必要な時にモーターにブレーキをかけると考えられています。このIF1は、ATPの結合する位置から90度回転したところでモーターを止めることもわかりました。この研究によって、ヒトのエネルギー生産の中枢を占めるATP合成酵素の回転モーター機構の解明の突破口が開かれました。
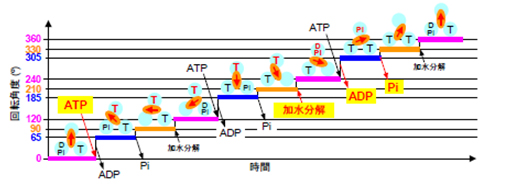
図2

