- HOME
- 研究・社会連携
- 産官学連携
- 研究探訪(研究者紹介)〜サギタリウスからのメッセージ〜
- 総合生命科学部 生命システム学科 永田 和宏 教授
総合生命科学部 生命システム学科 永田 和宏 教授
生命の営みの根源 細胞内タンパク質の品質管理メカニズムを解明
線維化疾患、神経変性疾患の治療法確立を目指す
社会の高齢化に伴い、肝硬変や動脈硬化症などの線維化疾患、アルツハイマー病などの神経変性疾患が増加。永田和宏教授の細胞内タンパク質の品質管理の研究がその突破口を開くものとして期待されています。

医療・創薬など極めて幅広い分野に応用可能な細胞内のタンパク質の品質管理機構を研究

当研究室のテーマは『個々の分子が細胞という場の中でどのような振る舞いをするか』。特に細胞内でのタンパク質の生成にかかわる研究が中心です。
人間の体には60兆個の細胞があります。活発な細胞では1秒間に数万個のタンパク質を作り、1個の細胞の中には80億個程のタンパク質が働いています。生命の営みの主役は、まさにタンパク質なのです。どのように正しいタンパク質が作られるかという研究は、医療・創薬など極めて幅広い分野に応用可能な研究です。
具体的に研究しているのは、細胞内のタンパク質の品質管理機構。細胞内では正しく生み出されたタンパク質だけでなく、細胞にかかる熱ショックなどの各種ストレスによって正常なタンパク質が傷害を受けることが多々あります。また遺伝的な変異によってどうしても正しいタンパク質を作り出せない場合もあります。これらを再生したり分解したりして、結果として正しいタンパク質が残るようにする絶妙の生理活動が、細胞内のタンパク質の品質管理です。
細胞内のタンパク質の品質管理は実際の工場に例えられます。 不良品ができたとき工場では、
- まず工場のラインを止め、不良品がこれ以上溜まらないようにする
- 直せるものは修理して出荷する
- 直せないときはその製品を工場から持ち出して廃棄処分する
- それでもだめなら工場を閉鎖する
…といった手順を踏みます。
実際の細胞内でも、それと同じことが行われています。
上記1.〜4.の工程はそれぞれ、
- RNAの情報をアミノ酸配列に「翻訳」する過程を停止、タンパク質を作らなくする
- 変性したタンパク質を再生する
- 変性したタンパク質を分解する
- 細胞が自分で自分を殺す(アポトーシス)
…となります。
こうしたメカニズムの詳細を明らかにすることで、タンパク質が細胞内で異常な状態になったときいかにしてそれを正すか、タンパク質の中でも特にコラーゲンに軸足を置いて研究しています。
-
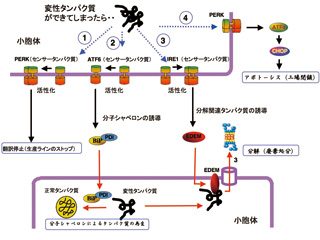
■品質管理の4つの戦略
-
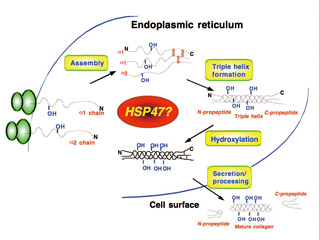
■コラーゲンの生合成に必須な分子シャペロンHsp47
“世界の永田”を決定づけた分子シャペロン“HSP47”の発見
タンパク質が作られるためには補助的な別のタンパク質が必要になります。これを分子シャペロンと言います。シャペロンとは本来、若い女性が社交界にデビューする際に付き添う年上の女性を意味するもので、分子シャペロンとは1本のひもであるポリペプチドを正しくフォールディング(折りたたみ)して、機能をもったタンパク質分子にするための“介添え役”のようなものです。
私は1986年、偶然のことからコラーゲンの生成にかかわる分子シャペロンを発見しました。コラーゲンの情報を受け取る受容体を探している最中にコラーゲンに結合するタンパク質を発見、詳しく調べると受容体ではなくシャペロンであること分かりました。それまでシャペロンといえばさまざまなタンパク質に無差別に結合するというのが常識。特定の物質を作り出すためのシャペロンは、そういう概念自体がありませんでした。
それだけに、コラーゲン生成に特異的な機能を持つ分子シャペロンの発見は大きな注目を集め、HSP47と命名しました。以来25年にわたって研究されてきましたが、“永田のHSP47”と呼ばれ、HSP47を扱った論文は600本以上も報告されています。
肝硬変・肺線維症・動脈硬化症などの線維化疾患
アルツハイマー病・ALSなどの神経変性疾患
コラーゲン生成に特異的な機能を持つ分子シャペロン・HSP47発見の現代的意義は肝硬変を筆頭とする肺線維症・腎線維症・動脈硬化症など、近年患者が急増してきている線維化疾患の治療に応用できる点にあります。
例えば、肝硬変。過度の飲酒や肝炎ウイルスなどで肝細胞が損傷を受けると、人間の体はそれを埋めるようにコラーゲンを作って“応急修理”します。それが繰り返されてコラーゲンを作り過ぎ、固くなった状態が肝硬変です。
動脈硬化も血管内にコレステロールがたまることだけが直接の原因ではなく、それが刺激となって血管の回り(外部)にコラーゲンによるマトリクス状組織が異常増成することで起きています。
要はいかにしてコラーゲン生成を特異的に止めるか。新たに作り出さないようにすれば、既にできたしまったコラーゲンはいずれ分解されてなくなるからです。
コラーゲンを作り出す分子シャペロン・HSP47の働きを阻害する物質を発見すれば、症状が分かっていても現時点では治療法がないこれら線維化疾患の治療薬を作り出せる可能性があります。既に理論は9割方完成しており、現在は経済産業省の関連機関と共同研究を進めながら、該当する天然物質を探している段階です。
タンパク質の品質管理機構では、タンパク質を作り出す機構だけでなく、間違って作られたタンパク質や、変性したタンパク質を分解する働きも重要です。
私たちは、これらにかかわるいくつかのキーとなるタンパク質を発見しました。まずは分解すべきタンパク質を正しく認識する役目のタンパク質「EDEM(エデム)」です。このタンパク質のおかげで正常なタンパク質を分解することなく、正しい処理ができることが分かりました。
さらにはターゲットのタンパク質を効率的に分解過程に引き渡す機能を担ったタンパク質「ERdj5」です。タンパク質はポリペプチドという1本のひも状のものがからまってできており、全体の形状を保つため、ひもにはところどころ結び目が作られています。ERdj5にはその結び目を切って1本のひも状に戻す機能があります。
これを別の分子シャペロンであるBIPが、再びからまって元に戻らないように保ちながら、分解の場であるプロテアソームという分子に渡し、そこで最終的に分解されます。
タンパク質の分解一つとっても、このようにさまざまなタンパク質がかかわり、複雑なメカニズムによってなされています。生命の営みの奥深さは測りしれません。
私の研究室では、細胞生物学を基本に、遺伝子・分子・細胞、個体の各レベルに及ぶ幅広い研究を展開しており、すべて自分たちが見つけた新しいタンパク質を対象に研究を進める「オリジナリティ重視」が伝統です。HSP47・EDEM・ERdj5のほかに、10種類ほど同ラボで発見したタンパク質があります。
現在は、これまでとは全く異なったタンパク質の品質管理機構を研究中で、この研究が進むと、アルツハイマー病・ハンチントン病・筋萎縮性側索硬化症(ALS)などの神経変性疾患にどのように細胞レベルで対処しようとしているのか、その基礎的なメカニズムがわかるのではないかと期待しています。
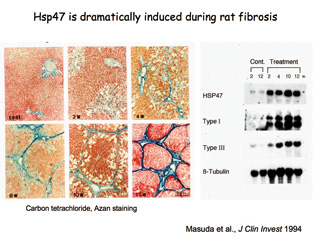
■肝硬変ラットの肝臓におけるコラーゲンの蓄積(青色)とHsp47の誘導(右図)
