- HOME
- 研究
- サイエンス&テクノロジー
- タンパク質合成装置リボソームでmRNAの翻訳を一時停止させるタンパク質を発見!—合成途上鎖の分子生物学—
タンパク質合成装置リボソームでmRNAの翻訳を一時停止させるタンパク質を発見!
—合成途上鎖の分子生物学—
総合生命科学部 生命システム学科 伊藤 維昭教授
合成途上鎖の分子生物学
リボソームは細胞内の他の酵素などに比べて巨大で、複雑な機能を持つまだまだ謎の多い細胞の装置です。リボソームの立体構造と機能を明らかにした3人の化学者に昨年、ノーベル化学賞が贈られました。そのリボソームの中で、これまでにない働きをするタンパク質を発見した伊藤維昭先生。世界的にもユニークな研究内容と今後の展望についてお話しいただきました。
リボソームも“なまもの”
細胞内に多数存在しているリボソームは、DNAから遺伝情報を転写したメッセンジャーRNA(mRNA )の遺伝暗号(コドン※1)をあたかもアミノ酸配列に翻訳するかのようにしてアミノ酸をつなぎ、タンパク質を合成しています。コドンに対応するアミノ酸はtRNA( 転移RNA )が運んできます。それがリボソームの酵素作用によって次々とペプチド結合※2されて、タンパク質ができあがるのです。
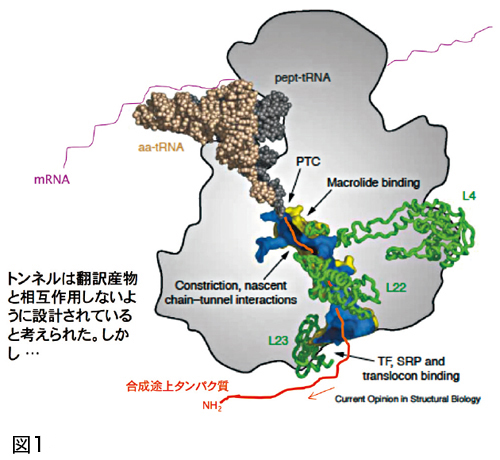
リボソーム自体は複数のRNA 分子とタンパク質からなっていて、雪だるまのような形をしています。だるまの上部にあたる部分が小サブユニット、下部が大サブユニットと呼ばれます。
大サブユニットのお腹の中にはトンネルがあります。小サブユニットでmRNAが読み取られ、大サブユニットの内部でアミノ酸がひとつひとつペプチド転移反応によって結合されます。そしてトンネルを通って順次リボソームの外に出てきて、普通はそのまま生まれ落ちます(図1、2)。
私たちはモデル生物である大腸菌のリボソームで、自らの翻訳(タンパク質合成)にブレーキをかけるタンパク質(正しくは完成したタンパク質になる前のできかけのタンパク質)を発見しました。これまで、リボソームの翻訳はどんなものでも自動的に行われているのだろうと考えられがちでしたが、リボソームも機械ではなく“なまもの”なのだということを改めて感じる発見でした。
※1 A(アデニン)U(ウラシル)C(シトシン)G(グアニン)の4 種の塩基で構成されるmRNA。3つの塩基の組み合わせが1つのアミノ酸に対応することで、20 種類のアミノ酸配列を決めている。この3つの塩基の組み合わせをコドンという。タンパク質の合成開始の信号となる「開始コドン」や合成を停止する「終止コドン」もある。
※2 アミノ酸同士が脱水縮合( 水分子H 2 Oが抜ける)して結合すること。
生まれかけで働くタンパク質 ─ SecM(分泌モニタータンパク質)
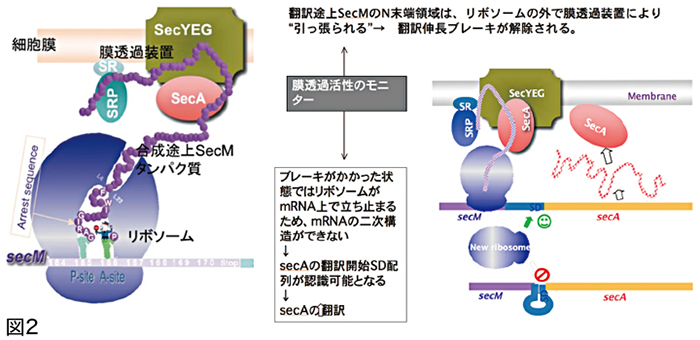
私たちが見つけたのは、SecMという小さなタンパク質で、170のアミノ酸からできています。ところが、リボソームで翻訳を進めていくと166 番目の辺りでリボソームと相互作用して、必ず止まってしまいます。リボソームを工場、タンパク質を工場で生産される製品だと考えると、製品が工場とやり取りして製造工程をストップさせているようなものです。一見困った行為ですが、研究を進めると、実はこの一時停止によってmRNA上で下流に位置するSecAというタンパク質の発現を調整していることがわかりました。
一時停止したSecMは、リボソーム内に40ほどのアミノ酸を残して、120ほどのアミノ酸をリボソームのトンネルの外に出した合成途上の状態です。リボソームの外にいるSecAが、外に出ているSecMをひっぱると合成が再開します。
SecAの量が少なくなっていると、なかなかSecMをひっぱることができないため、停止時間が長くなります。大腸菌などのバクテリアの場合、タンパク質のアミノ酸配列が始まる開始コドンのすぐ手前にSD 配列(シャイン・ダルガノ配列)という短い配列があって※3、これがリボソームのRNAの一部とペアを組んでくっつきます。リボソームはそのまますぐ近くにある開始コドンを読み始め、タンパク質合成が始まることになります。SD配列が隠れていると、リボソームが開始コドンに気づくことができずに、合成は始まりません(図2)。
mRNA 上には、SecAの合成を開始するためのSD 配列がありますが、そのSD配列を含む一部がヘアピン構造(部分的二重鎖)を作っています。このままではリボソームがSD 配列を読み取ることができないのですが、SecMの翻訳がストップすると、SecMを合成しているリボソームがmRNA 上のヘアピンがつくられる場所付近で立ち往生するため、mRNAはヘアピン構造がつくれません※4。するとSD 配列がむき出しとなるため、別のリボソームがSecAのSD 配列にくっつき、SecAが合成されるわけです。逆にSecAが十分量ある場合はSecMがすぐにひっぱられて、SecAのSD 配列のヘアピン構造が崩れる時がリボソームが通る一瞬しかないため、SecAの合成も始まりません。
さらに面白いのは、SecMは170のアミノ酸が結合されて分泌タンパク質として完成した後はすぐに分解されてしまうことです。つまり大人になってからではなく、できかけの赤ちゃんの状態で重要な働きをしているのです。
※3 各遺伝子の前に1つずつある。高等生物の場合はメカニズムが少し異なるが、キャップ構造が似た作用をする。
※4 二重鎖ヘアピン構造は水素結合という弱い結合でできているため、RNA helicase (二重鎖開裂酵素)活性を持つリボソームに接すると簡単に壊れる。この場合、リボソームがヘアピン構造付近で立ち往生するため、ヘアピンが壊れた状態のままになる。
リボソームの翻訳のスピードは一様ではない?!
複雑でロマンチックな生命の基礎原理に迫りたい
タンパク質の合成途中でブレーキをかけるタンパク質としては他に、一緒に研究している千葉志信先生が枯草菌でタンパク質膜組込装置の監視と発現調整を行うMifMというタンパク質を見つけています。このような作用をするタンパク質は、世界でもまだこの2つしか見つかっていません。
SecMとMifMは、アミノ酸配列も自然界での分布も異なりますから、それぞれの生物種が進化の過程で独自にこうした機能を獲得してきたと考えられます。リボソームは機械ではなく“なまもの”だと言いましたが、翻訳をストップさせるという一見不都合な行為で、他のタンパク質の分泌活性や膜組込異常を感知し、かつ他のタンパク質の発現を調整するという巧妙な働きをする生命の仕組みに、私はロマンチックなものを感じます。基礎研究は華々しい研究とはいえないかもしれません。しかし、大腸菌や酵母などで見つかった研究結果が人間につながることもありますので、生命の基礎原理に迫りたい人がもっと増えてくれたらいいなと常々思っています。
リボソームでは、自動的にタンパク質が合成されているのではないことがわかった今、私たちはリボソームの翻訳スピードは一様ではないのではと考えています。つまり、ブレーキをかけたり、スピードを緩めたりしながら生まれてくるタンパク質がもっと一般的に存在すると考えているのです。そのことによって、新たに生まれる「赤ちゃんタンパク質」が「大人タンパク質」になっていく過程が首尾よく進むという仮説です。このような、これまでの常識を越えた働きをするタンパク質を今後さらに探していきたいと考えています。
細胞膜に分泌タンパク質輸送のための穴を開けるタンパク質「SecY」の発見
私たちの体のいたるところで様々な働きをしているタンパク質の中には、膜タンパク質になったり、細胞の外に出て分泌タンパク質になったりするものもいます。これら表層タンパク質は医学的にも重要ですし、表層タンパク質に関する遺伝子がゲノムの約3割を占めていることからも、これらのタンパク質が重要な働きをしていることがわかります。
ところが、細胞膜はイオンですら簡単に通ることができません。イオンよりも大きなタンパク質はどうやって細胞膜を越えているのでしょう。
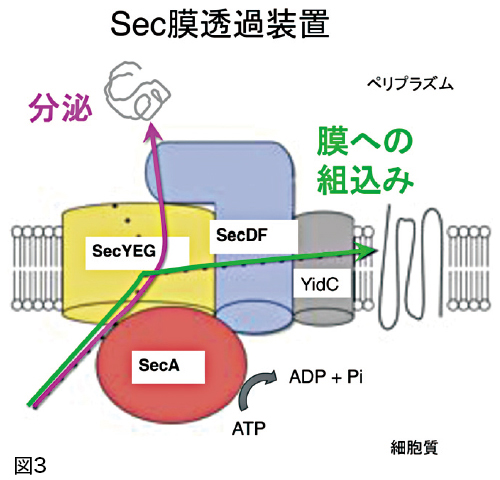
25年程前、大腸菌のリボソームタンパク質の遺伝子の変異株(何か問題があって他と異なる作用をするもの)を採取して分泌機能が損なわれた変異株を探す実験をしていたところ、細胞膜に穴を開けるようにして表層タンパク質を外へ通すタンパク質(SecY)の遺伝子を見つけました。その後SecYに関する研究を続けたところ、モータータンパク質SecAがSecY複合体(SecYEGの3つのタンパク質)に押し込んだ分泌タンパク質をSecYEGが協同で働いて細胞膜外へ通すことがわかりました(図3)。このSecYはタンパク質が膜の内部に組み込まれる時にも活躍しています。また、人間を含む高等生物にもSec61という同様の働きをするものがあることもその後の研究で明らかになりました。

総合生命科学部 生命システム学科 伊藤 維昭教授
- プロフィール
-
理学博士。専門は分子生物学、生化学。昔から、生物が「生きている」こと自体に興味があった。野山など、普段自分が目にしない場所でも様々な生物が生きていることに謎めいたものを感じていたからかもしれない。京都大学の理学部化学科を卒業後、高校生の頃には聞いたこともないDNAやRNAといった新しいものを扱っているウイルス研究所へ。いま何がわかっていて何がわかっていないのかということが最新の知識でわかるという本物の学問に魅せられて、研究者の道へと進んだ。「高校までとは違って、大学、大学院からは正解のない世界に入ることを意識してほしい」と伊藤先生。静岡県立磐田南高等学校OB。
