工学研究科 Toniti Waraphanさんと総合生命科学部 津下 英明 教授らの研究グループが新しく見つかったウェルシュ菌食中毒に関わる毒素の構造と機能を解明
2017.02.18
本学大学院生のToniti Waraphan(工学研究科・博士後期課程3年次)さん、総合生命科学部の吉田 徹 研究員、津下 英明 教授らと岩手大学 農学部 鎌田 洋一 教授らの研究グループが新しく見つかったウェルシュ菌の食中毒に関わるバイナリー毒素の構造と機能を明らかにしました。
本研究成果は、2017年2月15日付で、国際誌であるPLOS ONE(online版)に掲載されました。
本研究成果は、2017年2月15日付で、国際誌であるPLOS ONE(online版)に掲載されました。
掲載論文
Crystal structure and structure-based mutagenesis of actin-specific ADP-ribosylating toxin CPILE-a as novel enterotoxin
PLoS One. (2017) 12(2):e0171278. doi: 10.1371/journal.pone.0171278.
PLoS One. (2017) 12(2):e0171278. doi: 10.1371/journal.pone.0171278.
著者
Toniti W(京都産業大学), Yoshida T(京都産業大学), Tsurumura T(京都産業大学), Irikura D (堀場製作所), Monma C(東京都健康安全研究センター), Kamata Y(岩手大学), Tsuge H(京都産業大学)
発表内容
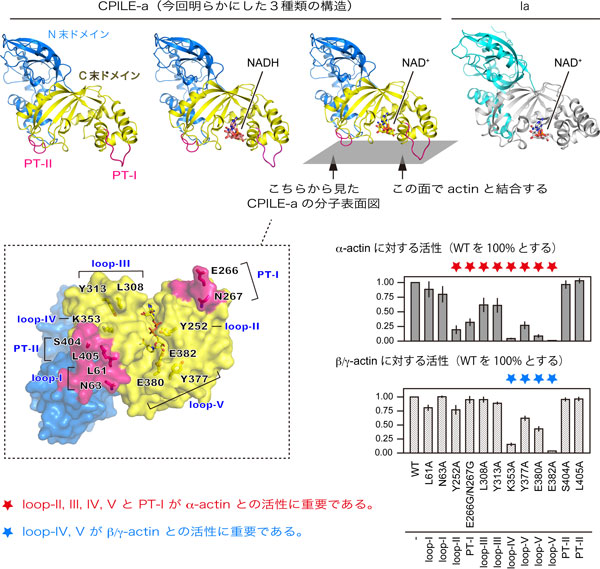
ウェルシュ菌による食中毒はエントロトキシン(CPE)という毒素によって引き起こされると考えられてきましたが、近年日本で発生した数件の食中毒は、CPE欠損のウェルシュ菌によるものであることが疑われました。新たな原因毒素としてbinary毒素が見つかりC. perfringens iota-like enterotoxin(CPILE)と命名されました。ウェルシュ菌のIota毒素(Ia)との類似性から、CPILEはCPILE-a(アクチン特異的なADP-リボシル化毒素)とCPILE-b(CPILE-aを細胞内に輸送する透過装置)からなると考えられます。今回我々は、CPILE-aの結晶構造を3種類の状態で、つまり基質なし・NAD+複合体・NADH複合体、各々で明らかにしました。Iaと構造を比較すると、Iaにはない2つのExtra Protruding Loop(PT-Iと PT-II)が存在することがわかりました(図)。
すでに我々のグループで研究が進んでいる、Iaと基質タンパクのアクチンとの複合体との結晶構造から、CPILE-a-actin複合体のモデルを構築し、アクチン結合部位と思われるアミノ酸の変異体を作成して、その役割を検討しました。Iaは2つのドメインからなり、C末端ドメインにNAD+が結合し、この周りの5つのループ(N末端ドメインのloop-I、C末端ドメインのloop-II~V:loop- Vには基質アミノ酸Arg177の認識に関わるARTT-loopの2つのGluも存在する)がアクチンとの結合に関与していることがわかっていましたが、CPILE-aでは、loop-II~IVと領域外のPT-Iの変異体もαアクチンとの結合すなわち活性に影響することがわかりました(図)。
その一方でβ/γアクチンに対する活性を見ると、loop-IVとVの変異体では活性が落ちましたが、その他の部位の変異体では大きく変化が見られませんでした。また、β/γアクチンに対するADP-リボシル化活性は、αアクチンに対する活性のわずか36%でした。この結果は、CPILE-a類似のボツリヌス菌の酵素C2-IIがβ/γアクチンしかADPリボシル化しないこととは対照的です。
このような、構造と機能の基礎研究は、将来的には阻害剤の創薬研究につながります。さらに、同研究グループでは構造が未知の膜結合透過装置CPILE-bの構造と機能の研究を進めています。
その一方でβ/γアクチンに対する活性を見ると、loop-IVとVの変異体では活性が落ちましたが、その他の部位の変異体では大きく変化が見られませんでした。また、β/γアクチンに対するADP-リボシル化活性は、αアクチンに対する活性のわずか36%でした。この結果は、CPILE-a類似のボツリヌス菌の酵素C2-IIがβ/γアクチンしかADPリボシル化しないこととは対照的です。
このような、構造と機能の基礎研究は、将来的には阻害剤の創薬研究につながります。さらに、同研究グループでは構造が未知の膜結合透過装置CPILE-bの構造と機能の研究を進めています。