クライオ電子顕微鏡により明らかにした細菌毒素タンパク質の膜透過機構『Nature Structural & Molecular Biology』オンライン版に掲載
2020.03.03
本研究成果は、2020年3月3日1時(日本時間)に英国科学誌『Nature Structural & Molecular Biology』オンライン版に掲載されました。
研究概要
タンパク質は20種類のアミノ酸からなる1本の紐ですが、これが規則的にαヘリックス、βシートと呼ばれる二次構造を取り、さらに折れ畳んで立体的な三次構造を形成することで初めて機能します。そのため、通常一度折れ畳んだ(フォールディングした)タンパク質は構造を失って、機能を持たない1本の紐にもどる(アンフォールディングする)必要はありません。しかし、ある種の細菌は、タンパク質毒素をアンフォールディングさせ、さらに膜透過をさせてホストの細胞内入れる装置を持っています。
ウェルシュ菌などの細菌が産生する二成分毒素は毒素タンパク質(酵素成分)とこれを宿主の細胞に入れるための透過装置(膜孔) から構成されています。透過装置(膜孔)によって形成される膜孔口径はとても小さいため、酵素成分がこのトンネルを通過する際には、一度形成された三次構造が解かれなければいけません。しかしながら、それがどのようにして起きるのかは明らかにされてきませんでした。
今回、本研究グループはウェルシュ菌タイプEが産生する、アクチンをADPリボシル化する酵素Iaと、Iaを細胞内へ輸送するIb膜孔で構成されるイオタ毒素の複合体の構造を明らかにすることに成功しました。クライオ電子顕微鏡を用いた単粒子構造解析によって、Ib膜孔とIaが結合したIb膜孔の複合体を2.8~2.9オングストロームという高い分解能で構造決定をしました。
研究の背景
ウェルシュ菌タイプEが産生するイオタ毒素はアクチンをADPリボシル化する酵素成分IaとIaを細胞内へ輸送するIb膜孔からなります。Ibは単量体として産生され、プロテアーゼによる分解、7量体化やエンドソームへの取り込みを経て細胞膜に孔を開ける膜孔を形成します。Iaはエンドソームと細胞質のpH差によって生じるエネルギーを利用して、Ib膜孔の中を透過していくと考えられています (図1)。
同じく二成分毒素である、炭疽菌毒素PA(Protective Antigen)もIbと同様な膜孔を形成することが知られています。PA膜孔は構造が明らかにされており、酵素成分が通過する狭窄部位(φクランプ)は、構造を持たない、ひも状のタンパク質しか通れないほど狭い(6Å)ことが報告されています。しかしながら、酵素成分がどのようにして構造を失うのかは明らかにされていませんでした。
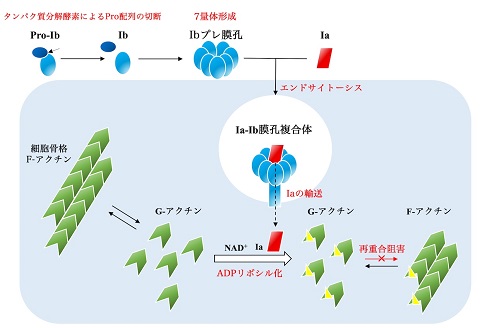
ウェルシュ菌から産生された膜結合成分Ibは膜孔を形成し、酵素成分Iaを細胞内に輸送する。Iaは細胞内に侵入すると細胞骨格を形成するアクチンをADPリボシル化し、アクチンの再重合を阻害する。
研究成果
この解析から、①Ib膜孔もPA膜孔のようにひも状のタンパク質しか通れない、狭窄部位(φクランプ)を有すること、②IaがどのようにしてIb膜孔に結合するのか、③IaのN末端がIb膜孔の中で空間的な制約によって構造を失い、ひも状になっている様子を明らかにしました(図3)。
これらの結果から、膜孔への結合が酵素成分の透過に不可欠な構造変化を引き起こすということがわかりました。
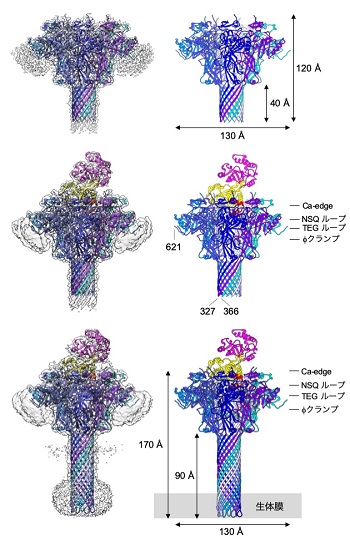
電子顕微鏡によって得られた密度マップおよび、これをもとに作成したモデルを表示している。上:Ib膜孔 中:Iaが結合したIb膜孔(short stem) 下:Iaが結合したIb膜孔(long stem)
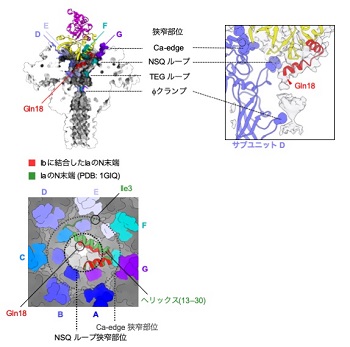
IaはIb膜孔への結合によって膜孔内部のNSQループと呼ばれる狭窄部位で二次構造であるヘリックスが失われる。解けたN末端は膜孔の更に深部にあるクランプへ続いている。
今後の展開
これらの構造を比較すると、Ib膜孔/Iaではそのストイキオメトリー、結合モードも大きく異なることがわかりました(図4)。また、Iaが結合したIb膜孔の複合体構造から、Iaのアンフォールディングと膜透過の機構を提唱しましたーすなわち「三次構造をとっているタンパク質がどのように解けて膜孔を透過するか」というタンパク質膜透過機構の一端の解明につながりました(図5)。すでに似た構造を持つ膜孔がナノポアシーケンサーとしてDNAシーケンスで用いられるようになっています。応用として、将来は、この膜孔装置を生かしたタンパク質のアミノ酸シーケンスも可能になると考えています。
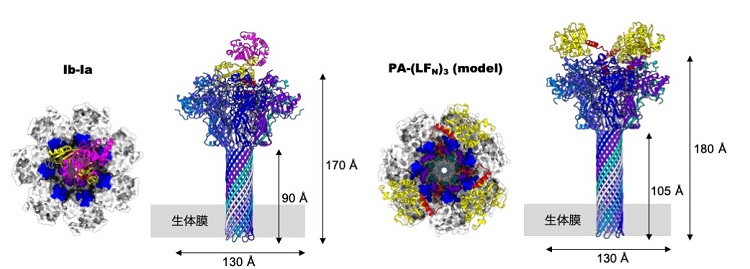
ウェルシュ菌 二成分毒素複合体(Ib-Ia) と炭疽菌 二成分毒素複合体(PA-3LFN)の構造の比較。炭疽菌は先行研究をもとに予想したモデルである。両者でIaとLFNの結合の仕方が大きく異なることがわかる。
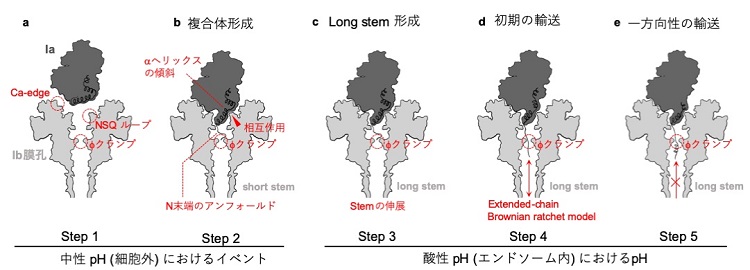
a. 一つのIaがIb膜孔に結合する(short stem)。 b. IaはIb膜孔への結合によってN末端の構造が失われる。エンドソーム中での酸性pHによってc. Ib膜孔のβバレルが完全に形成される (long stem)。d. 構造を失ったIaのN末端が狭いφクランプを透過する。 e. IaのN末端が再び構造を取り戻し、狭いφクランプによって逆行輸送が制限される。
用語・事項の説明
アンフォールディング
一方、アンフォールディングはこの折れ畳みが解けることを表す。一般的に、フォールディングしたタンパクは自然にはアンフォールディングせず、アンフォールディングさせるには何らかの機構が必要となる。二成分毒素では、酵素成分(A成分)をアンフォールディングさせた後、膜孔透過装置(B成分)を透過させ、さらにフォールディングさせるという、調整を行っている。
クライオ電子顕微鏡を用いた単粒子解析
二成分毒素
掲載論文
| 論文タイトル | Cryo-EM structures reveal translocational unfolding in clostridial binary iota toxin complex |
|---|---|
| 掲載誌 | 『Nature Structural & Molecular Biology』オンライン版 |
| DOI | https://doi.org/10.1038/s41594-020-0388-6 |
| https://rdcu.be/b2phT | |
| 研究体制 | 京都産業大学、大阪大学、筑波大学の研究グループの共同研究 |
| 著者 | 山田 等仁1 3、吉田 徹1 3、津下 英明2 3、川本 晃大1 4、光岡 薫4、岩崎 憲治5 ※1筆頭著者、2責任著者、3京都産業大学、4大阪大学、5筑波大学 |
