ミトコンドリアへのタンパク質搬入口TOM複合体の精密構造と働く仕組みを解明ー英国科学誌『Nature』オンライン版に掲載
2019.10.11
京都産業大学生命科学部 遠藤斗志也 教授らの研究グループは、ミトコンドリアへのタンパク質搬入のメカニズムを解明しました。
本研究成果は、2019年10月10日16時(英国時間)に、英国科学誌『Nature』オンライン版に掲載されました。
本研究成果は、2019年10月10日16時(英国時間)に、英国科学誌『Nature』オンライン版に掲載されました。
研究体制
京都産業大学,東京大学,フライブルグ大学,産業技術総合研究所,宮崎大学,モナシュ大学,金沢大学の研究グループの共同研究
発表論文
「Structure of mitochondrial import gate reveals distinct preprotein paths」
(ミトコンドリアのタンパク質搬入口の構造から明らかになった複数の前駆体タンパク質の通り道)
著者(1筆頭著者,2責任著者)(研究当時)
荒磯裕平1,阪上春花,柚木芳,鈴木純子,河野慎,遠藤斗志也2(京都産業大学)
包明久,吉川雅英(東京大学)
今井賢一郎(産業技術総合研究所)
塩田拓也(宮崎大学,オーストラリア・モナシュ大学)
Trevor Lithgow(オーストラリア・モナシュ大学)
Jian Qiu,Jiyao Song,Caroline Lindau,Lena-Sophie Wenz,Marilena Wischnewski,Conny Schütze,
Thomas Becker,Nils Wiedemann,Nikolaus Pfanner(ドイツ・フライブルグ大学)
有山弘高,安藤敏夫(金沢大学)
(ミトコンドリアのタンパク質搬入口の構造から明らかになった複数の前駆体タンパク質の通り道)
著者(1筆頭著者,2責任著者)(研究当時)
荒磯裕平1,阪上春花,柚木芳,鈴木純子,河野慎,遠藤斗志也2(京都産業大学)
包明久,吉川雅英(東京大学)
今井賢一郎(産業技術総合研究所)
塩田拓也(宮崎大学,オーストラリア・モナシュ大学)
Trevor Lithgow(オーストラリア・モナシュ大学)
Jian Qiu,Jiyao Song,Caroline Lindau,Lena-Sophie Wenz,Marilena Wischnewski,Conny Schütze,
Thomas Becker,Nils Wiedemann,Nikolaus Pfanner(ドイツ・フライブルグ大学)
有山弘高,安藤敏夫(金沢大学)
概要
ミトコンドリア(注1)は細胞内で生命活動に必要なエネルギーを産生します。そのため,ヒトではミトコンドリアが正常に機能することが健康につながり,ミトコンドリアの機能低下は老化やさまざまな病態と関連することが知られています。正常に機能するミトコンドリアを維持するためには,性質も機能も異なる1000種に及ぶタンパク質が必要です。こうした多様なタンパク質を、前駆体タンパク質(注2)という形で細胞質(外)からミトコンドリア内に膜を通して配送する必要があります(注3)。
このミトコンドリアへのタンパク質搬入口として働くのが,複数のタンパク質が組み合わさってできたTOM複合体(注4)です。今回,本研究グループは,TOM複合体の精密構造をクライオ電子顕微鏡を用いた単粒子解析法(注5)(分解能3.8Å)で決定しました。TOM複合体の全体構造は各サブユニット2個ずつから成る2量体で,タンパク質の通り道(膜透過チャネル)となる円筒形のTom40(注6)同士の界面にTom222分子と脂質1分子が入り込んでいました。一方,Tom40のN端部分は,Tom40の円筒内部をサイトゾル(外)側から膜間部(内)側に向かって貫き,Tom5が膜間部側でこのN端部分をつなぎ止めていました。多様な前駆体タンパク質のうち、プレ配列(注7)を持つものはTom40同士の界面の側に出口があり,プレ配列を持たないものはTom40の2量体の外側に出口がありました。このように,タンパク質の膜透過チャネル内に,プレ配列を持つ前駆体タンパク質と持たない前駆体タンパク質専用の通り道と出口を別々に用意し,出口で待ち構える各輸送経路の下流の因子に前駆体タンパク質を受け渡すことで,性質も機能も異なる1000種に及ぶ前駆体タンパク質の外膜透過を効率良く行っていることが分かりました。
ミトコンドリアへのタンパク質搬入のメカニズムの解明により,ミトコンドリアへのタンパク質配送に関連する病気の治療法の開発や,ミトコンドリアへのタンパク質配送の効率を制御することで老化を防ぐなどの可能性が開けることが期待されます。
なお,本研究は,日本学術振興会(JSPS)の科学研究費助成事業および国立研究開発法人科学技術振興機構(JST) の戦略的創造研究推進事業 チーム型研究(CREST),国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)の一環として行われました。
このミトコンドリアへのタンパク質搬入口として働くのが,複数のタンパク質が組み合わさってできたTOM複合体(注4)です。今回,本研究グループは,TOM複合体の精密構造をクライオ電子顕微鏡を用いた単粒子解析法(注5)(分解能3.8Å)で決定しました。TOM複合体の全体構造は各サブユニット2個ずつから成る2量体で,タンパク質の通り道(膜透過チャネル)となる円筒形のTom40(注6)同士の界面にTom222分子と脂質1分子が入り込んでいました。一方,Tom40のN端部分は,Tom40の円筒内部をサイトゾル(外)側から膜間部(内)側に向かって貫き,Tom5が膜間部側でこのN端部分をつなぎ止めていました。多様な前駆体タンパク質のうち、プレ配列(注7)を持つものはTom40同士の界面の側に出口があり,プレ配列を持たないものはTom40の2量体の外側に出口がありました。このように,タンパク質の膜透過チャネル内に,プレ配列を持つ前駆体タンパク質と持たない前駆体タンパク質専用の通り道と出口を別々に用意し,出口で待ち構える各輸送経路の下流の因子に前駆体タンパク質を受け渡すことで,性質も機能も異なる1000種に及ぶ前駆体タンパク質の外膜透過を効率良く行っていることが分かりました。
ミトコンドリアへのタンパク質搬入のメカニズムの解明により,ミトコンドリアへのタンパク質配送に関連する病気の治療法の開発や,ミトコンドリアへのタンパク質配送の効率を制御することで老化を防ぐなどの可能性が開けることが期待されます。
なお,本研究は,日本学術振興会(JSPS)の科学研究費助成事業および国立研究開発法人科学技術振興機構(JST) の戦略的創造研究推進事業 チーム型研究(CREST),国立研究開発法人日本医療研究開発機構(AMED)の創薬等ライフサイエンス研究支援基盤事業 創薬等先端技術支援基盤プラットフォーム(BINDS)の一環として行われました。
背景
ヒトや酵母などの真核生物の細胞内には,ミトコンドリアをはじめとする膜で仕切られた細胞内小器官が存在します。ミトコンドリアは細胞内で生命活動に必須のエネルギー生産を担っており,細胞にとってもヒトの健康にとっても重要な役割を果たしています。ミトコンドリアは外膜と内膜の二枚の生体膜に囲まれ,1000種類以上のタンパク質から構成されていますが,これらのタンパク質のほとんどは,ミトコンドリアの外,すなわちサイトゾルで前駆体として合成されてから,ミトコンドリアの中へ搬入されます。ミトコンドリアタンパク質前駆体がミトコンドリアに正しく搬入されるのは,前駆体に宛先すなわち「行き先シグナル」が書き込まれているからです。前駆体はミトコンドリア外膜上の受容体によって宛名が読み取られ,トランスロケーター(膜透過装置)が提供する通り道を介することで,通り道なしではタンパク質などの高分子は通過させない外膜を効率良く通過して,ミトコンドリア内に取り込まれます。さらに内部に向かう前駆体は,内膜上の別のトランスロケーターや外膜と内膜の間(膜間部)のシャペロンタンパク質の働きによって膜間部,内膜,その内側のマトリックスへと仕分けられ,運ばれていきます(図1)。TOM複合体は外膜のトランスロケーターで,行き先シグナルの受容体Tom20, Tom22や膜透過用のチャネルとして働くTom40などのタンパク質から構成され,ほとんど全てのミトコンドリアタンパク質をミトコンドリア内に取り込む汎用性の高い搬入口として働きます。これまで,TOM複合体は高分解能の精密構造が決定されておらず,各タンパク質がどのように集合して複合体をつくり,各タンパク質がどのように前駆体タンパク質を効率良く外膜透過させるかなどの問題は未解決でした。
研究成果
(1)クライオ電子顕微鏡(Cryo-EM)によるTOM複合体の精密構造決定
本研究グループは,酵母細胞からTOM複合体(Tom40,Tom22,Tom5,Tom6,Tom7の5種類のサブユニットから構成される膜タンパク質複合体)を精製し,東京大学のクライオ電子顕微鏡を用いてその構造を3.8Åの分解能で決定しました(図2)。全体構造は各サブユニット2個ずつから成る2量体で,タンパク質の通り道(膜透過チャネル)となる円筒形のTom40同士の界面に,Tom22二分子と脂質一分子が入り込んでいました。このため,Tom40のチャネルは互いに大きく(30°)傾き,外膜を局所的に大きくゆがめていました。一方,Tom40のポリペプチド鎖のN末端部分は円筒形のチャネル構造形成には関わりませんが,Tom40チャネルの孔を外(サイトゾル)側から内(膜間部)側に向かって貫き,膜間部側に出てきたN端部分をTom5がつなぎ止めていました。
(2)通過するタンパク質の出口が2つあることを発見
TOM複合体を通過した前駆体は,次の因子に引き渡されて,最終目的地に運ばれます。N端にミトコンドリア行きシグナルとして「プレ配列」を持つもの(ミトコンドリアタンパク質の7割はプレ配列を持っています)は,内膜のTIM23複合体と呼ばれるトランスロケーターに引き渡されて,内膜を通過してマトリクスに運ばれます(図1の①の経路)。今回,TIM23複合体のサブユニットTim50が,TOM複合体のサブユニットTom40のC端側やTom22の膜間部側のドメインと相互作用していることが分かりました。これらのドメインは2量体の内側,2つのTom40同士の界面の近くにあり,Tim50を含むTIM23複合体はTOM複合体の2量体の内側で,通過してくるプレ配列を持つ前駆体を待ち構えていることになります(図3)。
一方,多様な前駆体タンパク質のうち、プレ配列を持たない膜間部の可溶性タンパク質(ミトコンドリア行きのシグナルはプレ配列という形では書き込まれていない)は,TOM複合体からMia40というタンパク質の膜間部側ドメインへと引き渡されます(図1の④の経路)。今回,Mia40はTom40のチャネル内を貫いて膜間部側に出てくるTom40 のN端側と相互作用していることが分かりました。このN端部分は2量体の外側にあるTom5によって位置決めをされています。すなわち,膜間部の可溶性タンパク質がTom40チャネル内を通過してTim40に引き渡される出口は,TOM複合体の2量体の外側にあることが分かりました。Tom40のN端や,その位置決めをしている,Tom5やTom40チャネルの内側のアミノ酸残基に点変異や欠失変異を入れると,膜間部の可溶性タンパク質のTOM複合体通過,そしてその後のステップに欠損が出ることも確かめられました(図3)。私たちは以前,Tom40のN端側がsmall TIMと呼ばれる膜間部のシャペロンと相互作用していることを見いだしています。Small TIMはプレ配列を持たないタンパク質のうち,膜間部の可溶性タンパク質以外のものを膜間部で運ぶ因子です。したがって,プレ配列を持たないタンパク質は,全てTOM複合体の2量体の外側の出口を利用していることになります。
このようにタンパク質の膜透過チャネル内に,プレ配列を持つ前駆体タンパク質と持たない前駆体タンパク質専用の通り道と出口を別々に用意し,出口で待ち構える各輸送経路の下流の因子に前駆体タンパク質を別々に受け渡すことで,性質も機能も異なる1000種に及ぶ前駆体タンパク質の外膜透過を効率良く行っていることが明らかになりました。
一方,多様な前駆体タンパク質のうち、プレ配列を持たない膜間部の可溶性タンパク質(ミトコンドリア行きのシグナルはプレ配列という形では書き込まれていない)は,TOM複合体からMia40というタンパク質の膜間部側ドメインへと引き渡されます(図1の④の経路)。今回,Mia40はTom40のチャネル内を貫いて膜間部側に出てくるTom40 のN端側と相互作用していることが分かりました。このN端部分は2量体の外側にあるTom5によって位置決めをされています。すなわち,膜間部の可溶性タンパク質がTom40チャネル内を通過してTim40に引き渡される出口は,TOM複合体の2量体の外側にあることが分かりました。Tom40のN端や,その位置決めをしている,Tom5やTom40チャネルの内側のアミノ酸残基に点変異や欠失変異を入れると,膜間部の可溶性タンパク質のTOM複合体通過,そしてその後のステップに欠損が出ることも確かめられました(図3)。私たちは以前,Tom40のN端側がsmall TIMと呼ばれる膜間部のシャペロンと相互作用していることを見いだしています。Small TIMはプレ配列を持たないタンパク質のうち,膜間部の可溶性タンパク質以外のものを膜間部で運ぶ因子です。したがって,プレ配列を持たないタンパク質は,全てTOM複合体の2量体の外側の出口を利用していることになります。
このようにタンパク質の膜透過チャネル内に,プレ配列を持つ前駆体タンパク質と持たない前駆体タンパク質専用の通り道と出口を別々に用意し,出口で待ち構える各輸送経路の下流の因子に前駆体タンパク質を別々に受け渡すことで,性質も機能も異なる1000種に及ぶ前駆体タンパク質の外膜透過を効率良く行っていることが明らかになりました。
今後の展開
本研究で解析した酵母TOM複合体は,ヒト細胞でも同じメカニズムで膜透過装置として働くと考えられています。さらに,本研究で明らかになったTom40の2つの出口は,ヒト細胞のTom40にも存在します。すなわち本研究で明らかになったミトコンドリアへのタンパク質搬入口複合体が働く仕組みは,ヒトなどの高等生物における同様のメカニズムの理解に直結し,ミトコンドリアタンパク質の搬入と関連するパーキンソン病などの神経変性疾患や,難病で治療法開発が待たれているミトコンドリア病の病因メカニズム解明に資することが期待されます。将来的には,ミトコンドリアへのタンパク質の取り込み効率の制御により,ミトコンドリア機能や細胞機能を制御することで,未開発だったミトコンドリア病の治療法開発に道筋をつけることや老化の予防につながることも期待されます。
用語・事項の解説
1 ミトコンドリア
酵母からヒトまで広く真核生物の細胞内に見られる必須の細胞内小器官。生命活動に必要なエネルギー(ATP)を酸素呼吸によって産生するほか,さまざまな物質の代謝やアポトーシス(細胞死)にも関わる。ミトコンドリアの機能低下や機能異常と,老化やがん,糖尿病,さまざまなミトコンドリア病との関連が分かっている。ミトコンドリアの機能を健全に保つことがヒトの健康に重要であることから,異常ミトコンドリアを除去する方法や健全なミトコンドリアを増やす方法の開発が注目されている。
2 前駆体タンパク質
ミトコンドリアタンパク質の大部分はサイトゾルで「前駆体」として合成される。前駆体はミトコンドリア行きシグナルが「プレ配列」としてN末端に付加されたタイプのものと,そうでないものがある。前者はミトコンドリア内でプレ配列が切断されて「成熟体」となって機能するが,後者はミトコンドリア内で特に配列が変化することなく機能できるようになる。
3 タンパク質の配送機構
細胞内で合成されたタンパク質は,働くべき目的地に正しく配送される必要がある。ブローベルらはタンパク質には宅配便のように自分自身に宛名が書き込まれており,それを目的地の装置(トランスロケーターの受容体)が読み取る,という原理があることを発見した(1999年ノーベル生理学医学賞)。シェクマンとロスマンは,さらに小胞体からリソゾーム,細胞膜を含む細胞内膜系の間のタンパク質の輸送が小胞を介して行われ,小胞を生み出す膜,小胞,目的地の膜の間でタンパク質の選別の原理が働くことを見いだした(2013年ノーベル生理学医学賞)。このようにタンパク質の宛名や選別の仕組みについては理解が進んできたが,トランスロケーターがタンパク質をどう膜透過させるのかなどの詳細な仕組みの解明に必須となるトランスロケーターの構造については,原核生物の細胞膜や真核生物小胞体膜など分泌経路で働くトランスロケーターについてしか明らかになっていない。
4 TOM(translocase of the mitochondrial outer membrane)複合体
酵母からヒトまで保存されているミトコンドリア外膜のトランスロケーター(膜透過装置)で,ほとんど全てのミトコンドリアタンパク質のミトコンドリアへの搬入口として働く。ミトコンドリア行きシグナルを認識する受容体,ミトコンドリアタンパク質前駆体の外膜透過を行う円筒形チャネルタンパク質のTom40を含む7〜8種類のサブユニットから構成される膜タンパク質複合体。
5 クライオ電子顕微鏡による単粒子解析法
生体試料を液体窒素(-196℃)冷却下で急速凍結して電子線を照射し,生体分子を染色することなく電子顕微鏡で観察する(クライオ電子顕微鏡法)。これまでの精密構造決定の主役であったX線構造解析には試料の結晶化が必須だったが,良質のデータの高感度取得法および大量の画像データから三次元構造を再構成する手法(単粒子解析法)の開発により,結晶化しない生体試料でも解像度3Å程度の構造を決定することができるようになった。この方法の進展により,これまで結晶化が困難であったタンパク質の巨大複合体や膜タンパク質の構造解析が急速に進むようになった。2017年に,その開発に貢献した研究者3名がノーベル化学賞を受賞している。
6 Tom40
外膜でミトコンドリアタンパク質搬入(外膜透過)を担うTOM複合体の中心サブユニット。円筒形の「βバレル型」膜タンパク質で,円筒の内部を基質となる前駆体タンパク質が通過する。
7 プレ配列
ミトコンドリアタンパク質の前駆体の7割はN端にプレ配列と呼ばれる余分な配列が付加されている。プレ配列はミトコンドリア行きシグナルとして機能し,TOM複合体の受容体サブユニットに認識される。
参考図
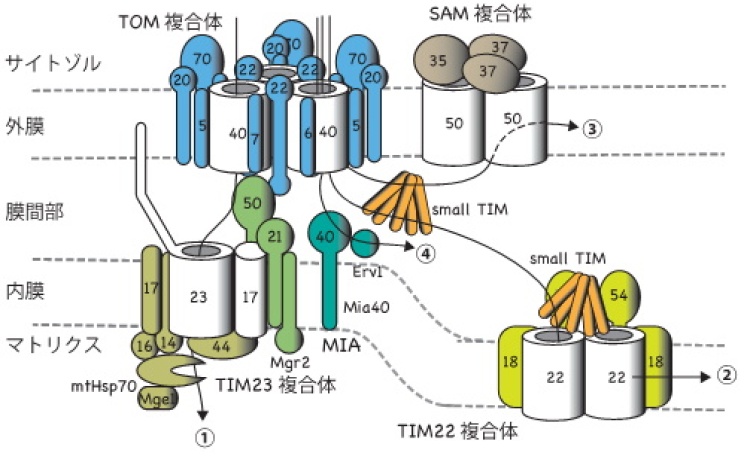
1000種類以上のタンパク質のミトコンドリアへの配送経路(黒矢印)。サイトゾルで合成されたミトコンドリア前駆体タンパク質の大部分は搬入口TOM複合体を通って外膜を通過し,目的区画に仕分けられる。TOM複合体は受容体や前駆体タンパク質の通り道を提供するチャネルタンパク質Tom40から構成される。ミトコンドリア外膜上でTOM複合体の主要分子種は3量体と考えられるが,電顕観察時には安定な2量体になりやすいらしい。
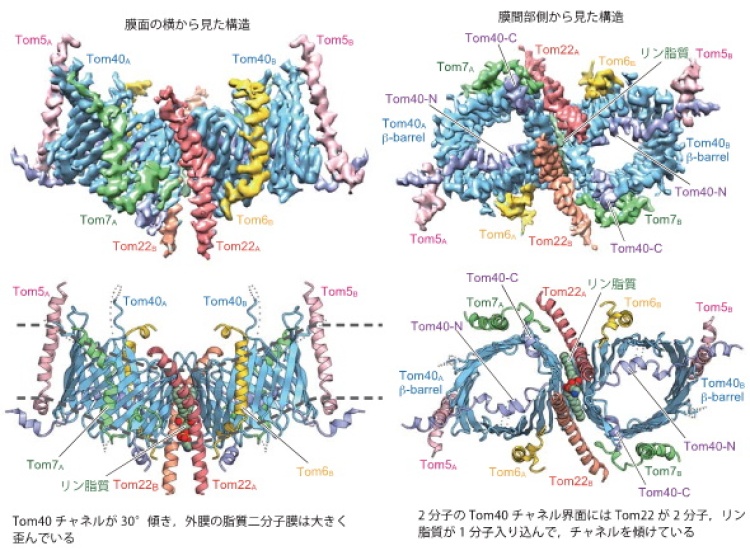
上段は決定構造の構造密度図。下段は構造をリボンモデルで見やすくしたもの。
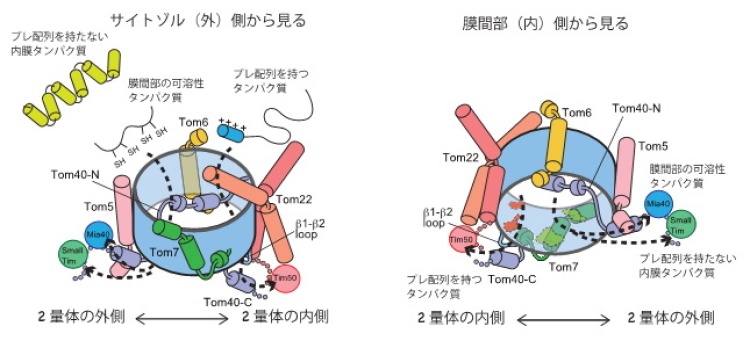
2量体のうち,1つ分を外側から見たものと,内部側から見たもので示した。出口が2つあることがわかる。
- お問い合わせ先
-
研究に関すること:
京都産業大学 生命科学部 遠藤 斗志也 教授(エンドウ トシヤ)
TEL:075-705-1508 Email:tendo@cc.kyoto-su.ac.jp
取材について:
京都産業大学 広報部
TEL:075-705-1411 FAX:075-705-1987 E-mail:kouhou-bu@star.kyoto-su.ac.jp
