タンパク質の細胞内輸送の校正システムを発見
2019.08.22
京都産業大学生命科学部 遠藤 斗志也 教授らの研究グループは、タンパク質の細胞内輸送校正システムを発見しました。
背景と概要
ヒトや酵母などの真核生物の細胞内には、ミトコンドリアや核、小胞体をはじめとする、膜で仕切られた細胞内小器官(オルガネラ)構造がつくられ、細胞に課せられた複雑な機能を分散管理しています。一方、細胞内でつくられる数万種類のタンパク質は、それぞれ働く場所が決まっており、サイトゾル、ミトコンドリア、核、小胞体(そこから細胞外)等、そのタンパク質が働くべき場所に運ばれることが、正常な細胞機能には不可欠です。数万種類におよぶタンパク質は、各々がどのようにして目的地を見出し、目的地に配送されるのか。このタンパク質配送の原理は、宅配便のシステムになぞらえることができます。すなわち、タンパク質自身には働くべき場所が宛名として書き込まれており、細胞内にはそれを読み取って目的地への配送を行うシステム(注1)が備わっていることが分かってきています。タンパク質の目的地への配送はきわめて正確に行われ、その配送が狂うと細胞機能は損なわれ、様々な病気につながるものと考えられてきました。
今回私たちは、タンパク質の細胞内配送には間違いが起こりうること、しかしいったん配送先を間違っても、配送をやり直す、すなわち校正を行うシステムが存在することをはじめて見出しました。生命活動の基本現象である、DNAの複製、DNAの情報に基づくタンパク質の合成などのプロセスについては、それらがきわめて重要であるが故に、たとえ間違いが生じてもそれを修正、校正する仕組みがあることがわかっています。今回タンパク質の配送という、やはり生命活動の基本的プロセスについても、そのやり直し、校正を行うシステムが発見されたことになります。これは生命の基本現象の理解を根本的に大きく前進させる発見です。
今回私たちは、タンパク質の細胞内配送には間違いが起こりうること、しかしいったん配送先を間違っても、配送をやり直す、すなわち校正を行うシステムが存在することをはじめて見出しました。生命活動の基本現象である、DNAの複製、DNAの情報に基づくタンパク質の合成などのプロセスについては、それらがきわめて重要であるが故に、たとえ間違いが生じてもそれを修正、校正する仕組みがあることがわかっています。今回タンパク質の配送という、やはり生命活動の基本的プロセスについても、そのやり直し、校正を行うシステムが発見されたことになります。これは生命の基本現象の理解を根本的に大きく前進させる発見です。
研究成果
(1)ミトコンドリアに誤配送されたタンパク質は小胞体の品質管理システムを介して分解される
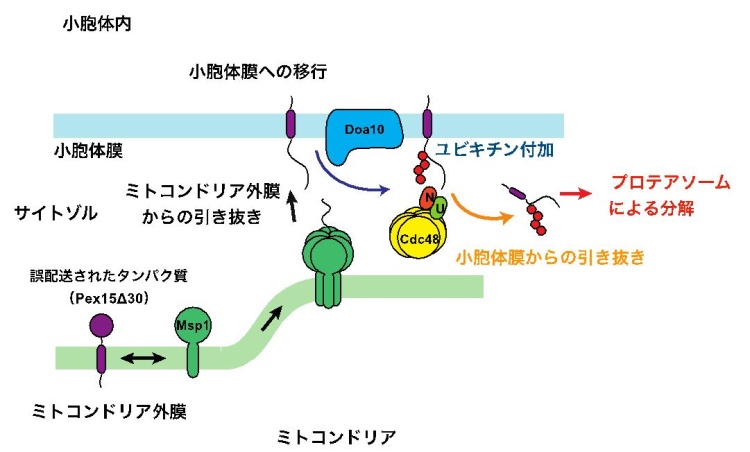
私たちは、ミトコンドリアに誤配送されたタンパク質の分解にMsp1 というタンパク質が関わるという、最近の報告に注目しました。実はMsp1 は、私たちが26 年前に発見したAAA-ATP アーゼ(注2)に分類されるタンパク質です。当時、ミトコンドリアの外膜にあることは分かりましたが、ATPを使ってそこで何をしているのかは長い間謎でした。ところが最近、ミトコンドリアの外膜に誤配送された、本来ペルオキシソームというオルガネラに行くべきタンパク質の分解にMsp1 が関わるらしいことが見出され、急速に研究が進み始めました。現在、Msp1 が関わる誤配送されたタンパク質の除去の仕組みの解明は、激しい競争が繰り広げられる研究分野となっています。
私たちは、ペルオキシソームにいくべきPex15 というタンパク質の変異体Pex15Δ30(ミトコンドリアに誤配送されます)を使って、Msp1 がどんなタンパク質と協力してPex15Δ30 の分解を促すのかを調べることにしました。まず、サイトゾルの巨大タンパク質分解マシンであるプロテアソーム(注3)が分解に関わるかどうかを調べました。プロテアソームの阻害剤の添加によってPex15Δ30 の分解が止まり、確かにPex15Δ30 はプロテアソームによってサイトゾルで分解されていることが分かりました。
プロテアソームがタンパク質を分解するときは、分解されるタンパク質には目印としてユビキチンという小さなタンパク質が付加されている必要があります(注3)。そこで、どんなタンパク質がPex15Δ30 に分解の目印としてのユビキチンを付加するかについて、候補となるユビキチン化酵素を網羅的に探索しました。その結果、Pex15Δ30 は意外にも、ミトコンドリアではなく小胞体に存在するDoa10 というユビキチン化酵素によってユビキチンが付加され、サイトゾルのプロテアソームで分解されることがわかりました。
小胞体では、小胞体膜や小胞体内部に異常タンパク質が生じると、これを見出してユビキチン化し、サイトゾルに送り出してプロテアソームで分解する強力な「品質管理」システム(注4)が存在することが知られています。Doa10 はこの品質管理システムの一員です。通常は、Doa10 が小胞体膜上の異常タンパク質をユビキチン化すると、サイトゾルからCdc48 というタンパク質(これもAAA-ATP アーゼの一種です)がやってきて異常タンパク質を小胞体膜からサイトゾルに引き出し、プロテアソームに受け渡すことが知られています。そこでPex15Δ30 の分解にCdc48 が関与するかについても調べたところ、確かにCdc48 がPex15Δ30 の分解に必要であることが分かりました。
私たちは、ペルオキシソームにいくべきPex15 というタンパク質の変異体Pex15Δ30(ミトコンドリアに誤配送されます)を使って、Msp1 がどんなタンパク質と協力してPex15Δ30 の分解を促すのかを調べることにしました。まず、サイトゾルの巨大タンパク質分解マシンであるプロテアソーム(注3)が分解に関わるかどうかを調べました。プロテアソームの阻害剤の添加によってPex15Δ30 の分解が止まり、確かにPex15Δ30 はプロテアソームによってサイトゾルで分解されていることが分かりました。
プロテアソームがタンパク質を分解するときは、分解されるタンパク質には目印としてユビキチンという小さなタンパク質が付加されている必要があります(注3)。そこで、どんなタンパク質がPex15Δ30 に分解の目印としてのユビキチンを付加するかについて、候補となるユビキチン化酵素を網羅的に探索しました。その結果、Pex15Δ30 は意外にも、ミトコンドリアではなく小胞体に存在するDoa10 というユビキチン化酵素によってユビキチンが付加され、サイトゾルのプロテアソームで分解されることがわかりました。
小胞体では、小胞体膜や小胞体内部に異常タンパク質が生じると、これを見出してユビキチン化し、サイトゾルに送り出してプロテアソームで分解する強力な「品質管理」システム(注4)が存在することが知られています。Doa10 はこの品質管理システムの一員です。通常は、Doa10 が小胞体膜上の異常タンパク質をユビキチン化すると、サイトゾルからCdc48 というタンパク質(これもAAA-ATP アーゼの一種です)がやってきて異常タンパク質を小胞体膜からサイトゾルに引き出し、プロテアソームに受け渡すことが知られています。そこでPex15Δ30 の分解にCdc48 が関与するかについても調べたところ、確かにCdc48 がPex15Δ30 の分解に必要であることが分かりました。
(2)Msp1 はミトコンドリアに誤配送されたタンパク質を外膜から引き抜き、小胞体膜に移行する機会を与える
次に、Msp1, Doa10、Cdc48 が働く順番を調べました。その結果、Msp1 がまずPex15Δ30 をミトコンドリア外膜から小胞体膜に移動させること、次にDoa10 が小胞体膜に移動したPex15Δ30 にユビキチンを付加すること、そしてユビキチンが付加されたPex15Δ30 はCdc48 によってサイトゾルに引き出されて、プロテアソームによる分解へと回ることが明らかになりました。すなわち、Msp1 はミトコンドリアに誤配送されたタンパク質をわざわざミトコンドリア外膜から小胞体膜に移動させ、小胞体の品質管理システムの助けを借りて、誤配送されたタンパク質を除去していることになります。Msp1 はATP のエネルギーを使ってPex15Δ30 をミトコンドリア外膜から引き抜きます。引き抜かれたPex15Δ30 は膜タンパク質なので、おそらく多くは再びミトコンドリア外膜に組み込まれますが、一部は近くに存在する小胞体膜に組み込まれるものと考えられます(図1)。すなわちミトコンドリアに誤配送されたPex15Δ30は配送をやり直す機会をMsp1 によって与えられたと考えられます。
なぜMsp1 はPex15Δ30 をわざわざミトコンドリアから小胞体に移動させてから、プロテアソーム分解へと回すのでしょうか。ミトコンドリアの外膜タンパク質が異常になった場合、これを効率よく分解除去しなければならないはずなのですが、こうした分解除去の仕組みが弱いのかもしれません。一方、小胞体には、細胞の拡大増殖や、外部からの要請に応じて、膨大な種類と量の分泌タンパク質が合成されて流入してきます。そこでこれらの膨大な種類と量のタンパク質の品質を常にモニターし、異常タンパク質を除去する、効率よく、強力な品質管理システムが働いています。したがってミトコンドリアに誤配送されたタンパク質も、もし異常タンパク質となるなら、小胞体の品質管理システムによって除去する方が効率が良いのかもしれません。
なぜMsp1 はPex15Δ30 をわざわざミトコンドリアから小胞体に移動させてから、プロテアソーム分解へと回すのでしょうか。ミトコンドリアの外膜タンパク質が異常になった場合、これを効率よく分解除去しなければならないはずなのですが、こうした分解除去の仕組みが弱いのかもしれません。一方、小胞体には、細胞の拡大増殖や、外部からの要請に応じて、膨大な種類と量の分泌タンパク質が合成されて流入してきます。そこでこれらの膨大な種類と量のタンパク質の品質を常にモニターし、異常タンパク質を除去する、効率よく、強力な品質管理システムが働いています。したがってミトコンドリアに誤配送されたタンパク質も、もし異常タンパク質となるなら、小胞体の品質管理システムによって除去する方が効率が良いのかもしれません。
(3)Msp1 によって小胞体に移行したタンパク質が異常でなければ、小胞体経由で本来の目的地への移行を実現することが可能となる
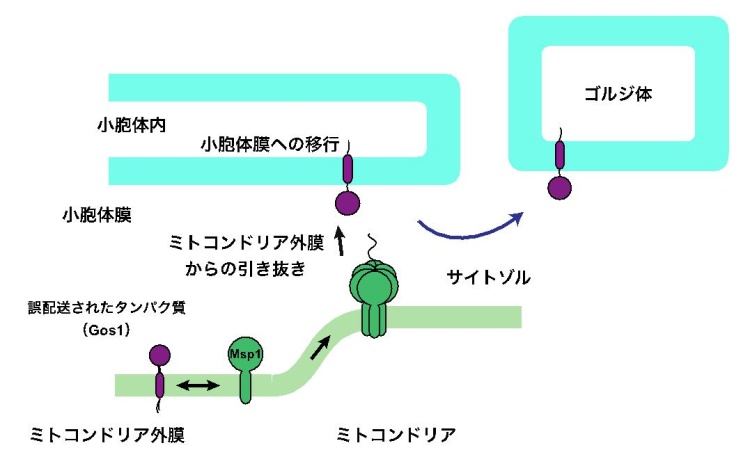
Pex15Δ30 以外のタンパク質がミトコンドリアに誤配送された場合はどうなるでしょうか。本来小胞体膜に組み込まれてからゴルジ体に配送されてゴルジ体膜上で働くGos1 というタンパク質があります。このタンパク質を、配送システムを変化させることで、ミトコンドリア外膜に誤配送させてみました。すると、Gos1 もミトコンドリア外膜からMsp1 によって引き抜かれ、一部は小胞体膜に移行することがわかりました。興味深いことに、Gos1 は小胞体膜上でDoa10 によるユビキチン化を受けることはありませんでした。したがってその後Cdc48 によってサイトゾルに引き出されてプロテアソームによって分解されることはありませんでした。そしてGos1 は本来の目的地であるゴルジ体まで小胞体から正しく配送されることがわかりました。Gos1 は小胞体の品質管理システムによって異常とはみなされず、いったん小胞体にさえ戻れば、ゴルジ体まで正しく運ばれることとなったのです(図2)。
(4)Msp1 はミトコンドリア外膜に誤配送されたタンパク質に配送のやり直し(校正)の機会を与える
Msp1 はミトコンドリア外膜に誤配送されたPex15Δ30 やGos1 などのタンパク質を何らかに仕組みで見出し、 ATPのエネルギーを使ってそれらを外膜から引き抜きます。引き抜かれたPex15Δ30 やGos1 は膜タンパク質なので、おそらく多くは再びミトコンドリア外膜に組み込まれますが、一部は近くに存在する小胞体膜に組み込まれるものと考えられます(細胞の中ではミトコンドリアと小胞体は近接しているところがたくさんあります)。すなわちミトコンドリアに誤配送されたPex15Δ30 やGos1 は配送をやり直す機会をMsp1 によって与えられたと考えられます。
小胞体には強力な品質管理システムが存在するので、配送をやり直したタンパク質が異常タンパク質とみなされれば、品質管理システムにより、分解除去へと回されます。Pex15Δ30 がその例となります。一方、配送をやり直したタンパク質が異常でなければ、本来の目的地へとさらに配送のやり直しを続けることができます。Gos1 がその例となります。
こうして、Msp1 はミトコンドリア外膜に誤配送されたタンパク質をATP のエネルギーを使って引き抜き、近くにある小胞体などの膜に配送をやり直させる機会を与えていることになります。これまでタンパク質の配送は正確に行われるべきであり、そのやり直しを行うタンパク質やシステムが存在するとは考えられていませんでした。しかしMsp1 の新しい機能の発見は、細胞内ではタンパク質の配送は間違いが起こりうること、しかし間違いが起こってもMsp1 などによってそれをやり直すことで、タンパク質の正しい配送や、誤配送されたタンパク質の除去ができること、そのことで細胞の正常機能の維持を実現していることがわかりました。
小胞体には強力な品質管理システムが存在するので、配送をやり直したタンパク質が異常タンパク質とみなされれば、品質管理システムにより、分解除去へと回されます。Pex15Δ30 がその例となります。一方、配送をやり直したタンパク質が異常でなければ、本来の目的地へとさらに配送のやり直しを続けることができます。Gos1 がその例となります。
こうして、Msp1 はミトコンドリア外膜に誤配送されたタンパク質をATP のエネルギーを使って引き抜き、近くにある小胞体などの膜に配送をやり直させる機会を与えていることになります。これまでタンパク質の配送は正確に行われるべきであり、そのやり直しを行うタンパク質やシステムが存在するとは考えられていませんでした。しかしMsp1 の新しい機能の発見は、細胞内ではタンパク質の配送は間違いが起こりうること、しかし間違いが起こってもMsp1 などによってそれをやり直すことで、タンパク質の正しい配送や、誤配送されたタンパク質の除去ができること、そのことで細胞の正常機能の維持を実現していることがわかりました。
(5)結論
今回、ミトコンドリア外膜のAAA-ATP アーゼであるMsp1 が、ミトコンドリア外膜に誤配送されたタンパク質を見出して引き抜く、ということを何度も繰り返すことで、配送やり直しの機会を与えることを見出しました。このことで、タンパク質配送の精度を保証し、誤配送されたタンパク質の除去を行うことができるようになります。これはタンパク質の細胞内での交通の新しい原理の発見ということができます。
今後の展開
今回の結果は、細胞内での配送は実は間違いが起こりうること、間違いが起こってもそれをやり直すことで、タンパク質の正しい配送や、誤配送されたタンパク質の除去を行い、細胞機能への障害の発生を防いでいることがわかりました。こうした誤配送のやり直し、すなわち「校正」はミトコンドリア以外のオルガネラにも存在する可能性がありますが、その探索は今後の課題です。さらにこうした配送の校正システムの異常が、細胞の機能欠損につながる可能性、個体の老化につながる可能性も考えられ、そのような方向での研究への展開を計画中です。将来的にはこうした校正システムの劣化を防ぎ、あるいはその能力を向上させることで、老化の予防につながることも期待されます。
備考
本研究は、日本学術振興会(JSPS)科学研究費補助金の特別推進研究「ミトコンドリア生合成を司る細胞内統合的ネットワークの解明」、および科学技術振興機構(JST) 戦略的創造研究推進事業 チーム型研究(CREST)の研究領域「ライフサイエンスの革新を目指した構造生命科学と先端的基盤技術(研究総括:田中啓二(東京都医学総合研究所所長))」における研究課題「ミトコンドリアをハブとする構造機能ネットワークの解明」の一環として行われました。
用語・事項の解説
1 タンパク質の配送機構
細胞内で合成されたタンパク質は、働くべき目的地に正しく配送される必要がある。ブローベルらはタンパク質には宅配便のように自分自身に宛名が書き込まれており、それを目的地の装置(受容体)が読み取る、という原理があることを発見した(1999 年ノーベル生理学医学賞)。シェクマンとロスマンは、さらに小胞体からゴルジ体、リソゾーム、細胞膜を含む細胞内膜系の間のタンパク質の輸送が小胞を介して行われ、小胞を生み出す膜、小胞、目的地の膜の間でタンパク質の選別の原理が働くことを見出した(2013 年ノーベル生理学医学賞)。
2 AAA-ATP アーゼ
AAA(ATPases Associated with diverse cellular Activities)-ATP アーゼは、ATP の結合と加水分解に伴ったエネルギーを使い、タンパク質の分解、膜融合、細胞内小器官の形成、DNA複製など多様な機能を発揮するタンパク質ファミリーの総称であり、バクテリアから真核細胞まで進化的幅広く保存されている。AAA-ATP アーゼタンパク質は、およそ230 のアミノ酸からなる共通のATP アーゼモジュール(AAAドメイン)を持ち、全てがリング状オリゴマー構造を取っている。
3 ユビキチン-プロテアソーム系
ユビキチン-プロテアソーム系はタンパク質に付加されたユビキチン鎖をプロテアソームが認識し、ATP 依存的で迅速かつ不可逆に標的タンパク質を分解するシステム。ユビキチンは、アミノ酸76 残基からなり、酵母からヒトまで普遍的に存在する進化的に保存されたタンパク質である。標的タンパク質へのユビキチン付加反応はユビキチン活性化酵素(E1)、ユビキチン結合酵素(E2)、ユビキチンリガーゼ(E3)によって行われる。この系は不要タンパク質の分解、抗原提示、細胞周期調節など重要な役割を果たしており、その異常はがんや感染症などの発症につながりうる。
4 小胞体品質管理システム
小胞体は分泌タンパク質や細胞膜タンパク質が合成される場であり、細胞内の約3 割に相当する大量のタンパク質が流れ込むため、特に堅牢な品質管理機構を備えている。小胞体に構造異常のタンパク質が発生すると、UPR(unfolded protein response)というストレス応答反応がおこり, 分子シャペロンや分解系酵素の発現が誘導される。小胞体で異常タンパク質を分解・除去する仕組みの一つがERAD(endoplasmic reticulum-associated degradation:小胞体関連分解)である。
論文タイトル
英:Msp1 clears mistargeted proteins by facilitating their transfer from mitochondria to the ER
和:Msp1 は誤配送されたタンパク質をミトコンドリアからER に移動させて除去する
著者(1筆頭著者、2責任著者)
松本俊介1、遠藤斗志也2、角田千香 (京都産業大学)
中務邦雄 (名古屋市立大学)
田村康 (山形大学)
江崎雅俊(熊本大学)
和:Msp1 は誤配送されたタンパク質をミトコンドリアからER に移動させて除去する
著者(1筆頭著者、2責任著者)
松本俊介1、遠藤斗志也2、角田千香 (京都産業大学)
中務邦雄 (名古屋市立大学)
田村康 (山形大学)
江崎雅俊(熊本大学)
参考図
- お問い合わせ先
-
研究に関すること:
京都産業大学 生命科学部 遠藤 斗志也 教授(エンドウ トシヤ)
TEL:075-705-1508 Email:tendo@cc.kyoto-su.ac.jp
取材について:
京都産業大学 広報部
TEL:075-705-1411 FAX:075-705-1987 E-mail:kouhou-bu@star.kyoto-su.ac.jp
