ミトコンドリアにおける膜電位の定説を覆す役割を解明-Scientific Reports誌に掲載
2019.07.02
京都産業大学生命科学部 遠藤 斗志也 教授、河野 慎 研究助教らの研究グループは、プレ配列をもつミトコンドリアタンパク質がミトコンドリア内に移行する際に必須の膜電位の定説を覆す役割を解明することに成功した。ミトコンドリアの機能低下などの障害を回復する道が開けることが期待される。
ミトコンドリアは生命活動に必要なエネルギーの大部分作り出す、細胞内の発電所にあたる細胞内小器官である。ミトコンドリアを構成する1000種におよぶタンパク質の大部分は、ミトコンドリアの外(サイトゾル)で作られてからミトコンドリアに運ばれる。特にミトコンドリアのマトリクスにおけるタンパク質の場合は、外膜と内膜の2つの膜を通過して初めてマトリクスに到達できるが、このとき、マトリクスのATPと内膜の膜電位という2つのエネルギーが必要となる。ATPはミトコンドリアタンパク質をマトリクス側から引っ張るモータタンパク質Hsp70の作動に必要であることは先行研究で明らかになっていたが、膜電位の役割については十分に解明されていなかった。
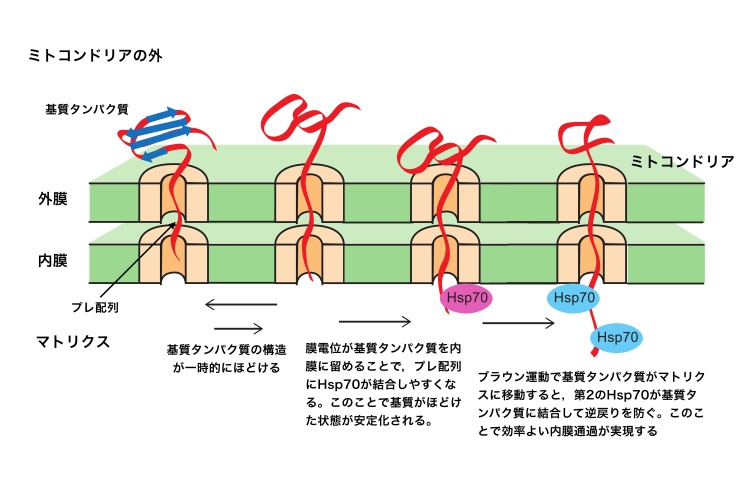
ミトコンドリアタンパク質がミトコンドリアの外膜や内膜のチャネル(孔)を通過するとき、その構造がほどけてひものようにならないとチャネルにひっかかって通過できない。これまで、内膜の膜電位はマトリクス側が負、膜間部側が正であり、ミトコンドリアタンパク質のN端にある、正に荷電したプレ配列をマトリクスへと引っ張ることで、後ろに続くタンパク質部分の構造がほどける現象(アンフォールディング)を引き起こすという考え方が提唱されていた。
しかし、今回の研究でこの説が間違っていることを明らかにした。具体的には、内膜の膜電位は、通過する基質タンパク質のプレ配列が内膜からはずれないようにすることで、プレ配列にマトリクスのモータタンパク質Hsp70が結合しやすくする働きがあることを解明した。Hsp70がプレ配列にしっかり結合できることで、Hsp70は「ブラウニアンラチェット」という仕組みにより、タンパク質をほどき、タンパク質をマトリクスに効率よく引き込むことが可能となる。
本研究の成果により、ミトコンドリアに運ばれる効率が低い、比較的プレ配列の短いタンパク質であっても輸送効率を上げることが可能となり、ミトコンドリアの機能低下などの障害を回復する道が開けることが期待される。
この研究成果は、2019年5月21日Scientific Reports誌に掲載された。
むすんで、うみだす。 上賀茂・神山 京都産業大学
関連リンク
- Scientific Reports誌掲載論文「Role of the membrane potential in mitochondrial protein unfolding and import」
https://www.nature.com/articles/s41598-019-44152-z - エントロピーが駆動する新たなミトコンドリアタンパク質輸送機構を発見
https://www.kyoto-su.ac.jp/news/20190204_345_release_ka01.html - ミトコンドリアのポリンがミトコンドリアタンパク質搬入装置の集合を制御することを発見
https://www.kyoto-su.ac.jp/news/20190207_345_release_ka01.html - 京都産業大学研究ブランディングサイト「生命とタンパク質の世界」
https://www.kyoto-su.ac.jp/protein/
リリース日:2019-07-02