【米国科学誌PNAS掲載】世界初!核内の分解標的タンパク質を核外に運び出すメカニズムを解明
2018.04.17
核内の分解標的タンパク質を核外に運び出すメカニズムを解明
~UBIN-POSTシステムが核内ユビキチン化タンパク質の異常蓄積を解消し、
遺伝情報保存の場である核を保護する~
リリース日:2018-04-17
ポイント
- タンパク質分解の主要経路であるプロテアソームを阻害した時に、分解標的タンパク質は細胞核の外に優先的に蓄積すること、それは分解標的タンパク質が核の外に積極的に運び出されているためであることを、世界で初めて見い出した。
- 分解標的タンパク質は分解に先立って、ユビキチン化と呼ばれる化学修飾を受けるが、ユビキチン結合タンパク質UBINがこの状態を認識し、核シャトル因子POSTと協力して、標的タンパク質を核から運び出していることを明らかにした。
- モデル生物である線虫においてUBIN-POSTの機能を落とすと、本来分解すべきタンパク質がゲノムの保存場所である核の中に蓄積してしまい、寿命が短くなった。
- このようなメカニズムは、遺伝情報の保存場所である核を健康な状態に保つためのものと考えられた。老化、神経変性疾患などにおいては細胞内のタンパク質分解不全が起こり、細胞の機能低下をまねくが、そのような異常状態に対処するための防御反応を、今回見い出した。
細胞内で機能するタンパク質は、その役割を終える、もしくは正しく機能できなくなると、ユビキチン化*1)を受けプロテアソーム*2)による分解を受けます。このような経路がはたらかなくなると、分解が追いつかなくなったユビキチン化タンパク質が細胞内に蓄積するようになり、細胞の機能低下をまねきます。
今回、京都産業大学の永田 和宏教授、東京大学の平山 尚志郎助教らのグループは、ユビキチン化タンパク質が増えすぎた場合、それらは核から細胞質*3)に運び出されること、そのメカニズムとして、UBIN・POST複合体がはたらいていることを見いだしました。モデル生物である線虫*4)において、RNAi*5)という手法によりUBINとPOSTタンパク質の発現量を低下させると、ユビキチン化タンパク質が核内*6)に蓄積するようになること、このとき線虫の寿命が短くなることから、ユビキチン化タンパク質の核外への運び出しは、細胞機能の恒常性*7)を維持するために重要な仕組みであることを初めて明らかにしました。
本研究成果は、米国科学誌「Proceedings of the National Academy of Sciences(PNAS)」に掲載されました。
今回、京都産業大学の永田 和宏教授、東京大学の平山 尚志郎助教らのグループは、ユビキチン化タンパク質が増えすぎた場合、それらは核から細胞質*3)に運び出されること、そのメカニズムとして、UBIN・POST複合体がはたらいていることを見いだしました。モデル生物である線虫*4)において、RNAi*5)という手法によりUBINとPOSTタンパク質の発現量を低下させると、ユビキチン化タンパク質が核内*6)に蓄積するようになること、このとき線虫の寿命が短くなることから、ユビキチン化タンパク質の核外への運び出しは、細胞機能の恒常性*7)を維持するために重要な仕組みであることを初めて明らかにしました。
本研究成果は、米国科学誌「Proceedings of the National Academy of Sciences(PNAS)」に掲載されました。
研究の背景
動物細胞内の恒常性は様々なタンパク質品質管理機構により保たれています。細胞内で合成されたタンパク質は分子シャペロン*8)により正しく機能する形に整えられます。役割を終えたタンパク質や、遺伝子変異、細胞外からのストレスにより、本来とは異なる構造をとるタンパク質は、ユビキチン化を受け、プロテアソームやオートファジー*9)による分解を受けます。このようなタンパク質品質管理機構の破綻は、細胞内でのユビキチン化タンパク質の蓄積を引き起こします。蓄積したユビキチン化タンパク質はアグリソーム*10)と呼ばれる細胞質の構造体に隔離されると考えられています。
アルツハイマー病、パーキンソン病などの神経変性疾患では患者さんの神経細胞内、主として細胞質内に異常なユビキチン化病因タンパク質の蓄積が共通して観察されることが知られており、異常な病因タンパク質は細胞にとって毒性があり、異常タンパク質を分解除去し隔離する機構は、ヒトの健康にとって重要な機構であることがわかっています。
これまでの研究から、プロテアソームの機能が低下した時、ユビキチン化タンパク質は核内ではなく優先的に細胞質に蓄積し、アグリソームに隔離されることが知られていました。しかしながらなぜ核ではなく細胞質に優先的にユビキチン化タンパク質が蓄積するのかという現象とその生理的意義について、全くといっていいほど注目されてきませんでした。
アルツハイマー病、パーキンソン病などの神経変性疾患では患者さんの神経細胞内、主として細胞質内に異常なユビキチン化病因タンパク質の蓄積が共通して観察されることが知られており、異常な病因タンパク質は細胞にとって毒性があり、異常タンパク質を分解除去し隔離する機構は、ヒトの健康にとって重要な機構であることがわかっています。
これまでの研究から、プロテアソームの機能が低下した時、ユビキチン化タンパク質は核内ではなく優先的に細胞質に蓄積し、アグリソームに隔離されることが知られていました。しかしながらなぜ核ではなく細胞質に優先的にユビキチン化タンパク質が蓄積するのかという現象とその生理的意義について、全くといっていいほど注目されてきませんでした。
研究の内容と成果
今回、京都産業大学の永田和宏教授、東京大学の平山尚志郎助教らのグループは、ユビキチン化タンパク質が核から細胞質に運び出されていること、ユビキチン認識タンパク質UBINとその共役因子POSTがユビキチン化タンパク質の核外への運び出しを担っていることを、世界で初めて見いだしました。(図1, 図3)
これまでユビキチン化タンパク質が核から細胞質へ運び出されていること、運び出しに関与する因子が存在することは知られておらず、核の機能維持機構の観点から重要な発見です。
UBINは、ユビキチン化タンパク質を捕捉しプロテアソームに連れて行くこと、小胞体*11)やミトコンドリア*12)に局在する疎水性領域*13)を持つタンパク質の品質管理に機能することが知られていましたが、細胞質と核を行き来するタンパク質であることは知られていませんでした。今回の研究で、UBINのコファクターPOSTが同定され、POSTがCrm1タンパク質とともにUBINを核から細胞質に運び出していること、UBINとPOSTが細胞質と核を行き来することでユビキチン化タンパク質を細胞質に運び出していることを見いだしました。
RNAiという手法を用いて、UBINもしくはPOSTのタンパク質発現量を抑えた線虫を用い、ユビキチン化タンパク質の蓄積を観察すると、野生型の線虫と比較して、UBINもしくはPOSTの発現量が低下した線虫では、核内にユビキチン化タンパク質の凝集体*14)が観察されました(図2)。また、UBINとPOSTのタンパク質発現量を抑えた線虫では野生型の線虫と比較し、寿命が短くなることが明らかになりました。
以上のことから核から細胞質にユビキチン化タンパク質を運び出す機構は、細胞や生体の恒常性を維持する上で重要な機構であることが明らかになりました(図3)。
これまでユビキチン化タンパク質が核から細胞質へ運び出されていること、運び出しに関与する因子が存在することは知られておらず、核の機能維持機構の観点から重要な発見です。
UBINは、ユビキチン化タンパク質を捕捉しプロテアソームに連れて行くこと、小胞体*11)やミトコンドリア*12)に局在する疎水性領域*13)を持つタンパク質の品質管理に機能することが知られていましたが、細胞質と核を行き来するタンパク質であることは知られていませんでした。今回の研究で、UBINのコファクターPOSTが同定され、POSTがCrm1タンパク質とともにUBINを核から細胞質に運び出していること、UBINとPOSTが細胞質と核を行き来することでユビキチン化タンパク質を細胞質に運び出していることを見いだしました。
RNAiという手法を用いて、UBINもしくはPOSTのタンパク質発現量を抑えた線虫を用い、ユビキチン化タンパク質の蓄積を観察すると、野生型の線虫と比較して、UBINもしくはPOSTの発現量が低下した線虫では、核内にユビキチン化タンパク質の凝集体*14)が観察されました(図2)。また、UBINとPOSTのタンパク質発現量を抑えた線虫では野生型の線虫と比較し、寿命が短くなることが明らかになりました。
以上のことから核から細胞質にユビキチン化タンパク質を運び出す機構は、細胞や生体の恒常性を維持する上で重要な機構であることが明らかになりました(図3)。
今後の展開
アルツハイマー病や、パーキンソン病などの神経変性疾患において広く観察される病理所見として、細胞質における病因タンパク質の蓄積と凝集体の形成が上げられます。一方、神経変性疾患の一つであるポリグルタミン病の原因となるポリグルタミン領域を持つ一部のタンパク質は、細胞質のみならず核にも凝集体を形成し蓄積します。このように疾患によって凝集形成の場が異なることは知られているものの毒性や疾患の進行との関わりは明らかになっていません。今後、明らかになったユビキチン化タンパク質の核外排出機構が、神経変性疾患と関わりがあるのか明らかにすることで、病気の理解と治療につながると期待しています。
さらに、ユビキチン化タンパク質の核外排出に関わる因子を網羅的に明らかにすることで、ユビキチン化タンパク質の核外排出機構の全貌と生理的意義を明らかなると考えられます。
さらに、ユビキチン化タンパク質の核外排出に関わる因子を網羅的に明らかにすることで、ユビキチン化タンパク質の核外排出機構の全貌と生理的意義を明らかなると考えられます。
参考図
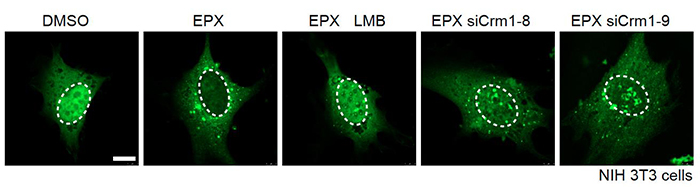
図1.ユビキチン化タンパク質は核から細胞質に運び出されている
(プロテアソーム阻害時、Crm1阻害時のユビキチン化タンパク質蓄積の様子)
培養細胞にタグつきのユビキチン化タンパク質を発現させると核内(破線で囲った部分)に局在が観察されるが、細胞をプロテアソーム阻害剤Epoxomicin (EPX)で処理すると、ユビキチン化タンパク質は核ではなく細胞質(破線の外側)に蓄積するようになる。点状にみえるものは凝集体。核から細胞へのタンパク質輸送はCrm1が主要な機能を果たしている。プロテアソーム阻害時にCrm1の機能を阻害剤のLeptomycin B (LMB)やsiRNA(siCrm1-8もしくはsiCrm1-9)で阻害すると、核内(破線の内側)にユビキチン化タンパク質の蓄積が観察される。この結果からユビキチン化タンパク質が核から細胞質に運び出されていることが明らかになった。
(プロテアソーム阻害時、Crm1阻害時のユビキチン化タンパク質蓄積の様子)
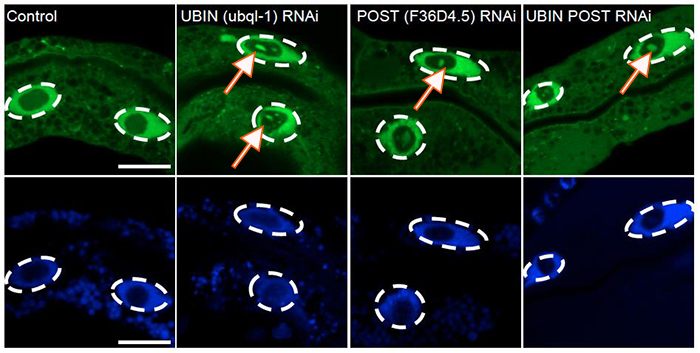
図2.UBIN-POSTの機能阻害は、ユビキチン化タンパク質の核への蓄積を引き起こす
線虫に蛍光タンパク質タグつきのユビキチン化タンパク質を発現させると核内(破線で囲った部分)に局在が観察される。このときにUBINもしくはPOSTをRNAi法によりノックダウンすると、核内にユビキチン化タンパク質の凝集体(矢印)が観察された。この結果からUBINとPOSTがユビキチン化タンパク質を核から細胞質に運び出しており、その機能を阻害するとユビキチン化タンパク質が核内に蓄積し凝集体を形成することが明らかになった。緑:GFP-ubiquitin 青:DNA染色(核)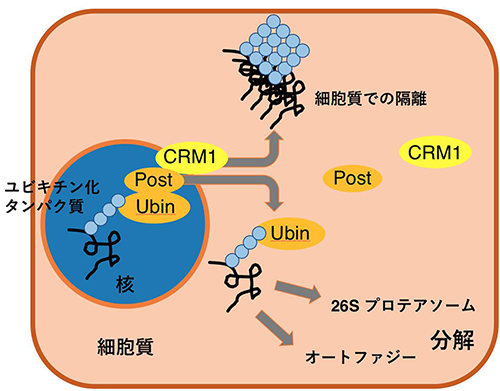
図3.UBINとPOSTによるユビキチン化タンパク質の核から細胞質への運び出し
核内でユビキチン化を受けたタンパク質は、UBINとPOSTにより捕捉される。UBINとPOSTはCrm1というタンパク質により核から細胞質に運び出される。このとき、ユビキチン化タンパク質も核から細胞質に運び出されることが明らかになった。細胞質に運び出されたユビキチン化タンパク質はアグリソームと呼ばれる構造体に隔離される。用語解説
*1)ユビキチン化
76アミノ酸からなるタンパク質ユビキチンにより、基質タンパク質のリジン残基が修飾されること。基質タンパク質に付加されたユビキチンがさらにユビキチン化されることにより、タンパク質分解のシグナルとなる。
*2)プロテアソーム
細胞質ゾルと核内に局在し、ポリユビキチン化タンパク質を分解する巨大な酵素複合体のこと。
*3)細胞質
細胞の中の細胞核以外の領域のこと。リボソームや分子シャペロンが豊富に存在し、タンパク質合成の場としても働く。
*4)線虫
土壌にすむ非線形生物。モデル生物としてよく利用される。
*5)RNAi
RNA interferenceの略。二本鎖RNAと相補的なmRNAがRISC complexにより分解される現象。この現象を利用して、狙ったタンパク質の発現量を抑えることが可能となる。
*6)核(細胞核)
細胞内の染色体、遺伝情報の保存、管理、遺伝子発現の制御を行う場。
*7)分子シャペロン
タンパク質の折り畳み(フォールディング)を助けるタンパク質の総称。「シャペロン」とはフランス語で若い女性が社交界デビューする際、付き添う介添人の意味があり、タンパク質が成熟するのを助ける。
*8)恒常性
生物においては、周りの環境に作用されず、生体の状態が一定に保たれる性質。
*9)オートファジー
プロテアソームとともに細胞内のタンパク質を分解するための重要な機構。異常なタンパク質や、ユビキチン化タンパク質を分解し、過剰な蓄積を防ぐ。
*10)アグリソーム
異常なタンパク質凝集体形成の場。微小管とダイニン依存的に形成されることから、制御された機構である。細胞保護的な機能があると考えられている。
*11)小胞体
網目状に連なる膜性の細胞小器官で、細胞内のカルシウムの貯蔵のほか、分泌タンパク質のフォールディングや修飾、脂質代謝、細胞内物質輸送などを担う。
*12)ミトコンドリア
酸素呼吸の場として働く細胞内小器官。
*13)疎水性領域
タンパク質が持つ水になじまない領域で、細胞内で疎水性領域同士は会合しやすい。細胞内で生じた異常タンパク質は疎水性部分を分子表面に露出し、タンパク質凝集体形成や、細胞毒性を発揮すると考えられている。
*14)凝集体(タンパク質凝集体)
疎水性領域を分子表面に露出したタンパク質が本来の機能に反して、凝集したもの。神経変性疾患の原因となるタンパク質など凝集しやすいこと、凝集したタンパク質は細胞内で毒性を発揮することが知られている。
76アミノ酸からなるタンパク質ユビキチンにより、基質タンパク質のリジン残基が修飾されること。基質タンパク質に付加されたユビキチンがさらにユビキチン化されることにより、タンパク質分解のシグナルとなる。
*2)プロテアソーム
細胞質ゾルと核内に局在し、ポリユビキチン化タンパク質を分解する巨大な酵素複合体のこと。
*3)細胞質
細胞の中の細胞核以外の領域のこと。リボソームや分子シャペロンが豊富に存在し、タンパク質合成の場としても働く。
*4)線虫
土壌にすむ非線形生物。モデル生物としてよく利用される。
*5)RNAi
RNA interferenceの略。二本鎖RNAと相補的なmRNAがRISC complexにより分解される現象。この現象を利用して、狙ったタンパク質の発現量を抑えることが可能となる。
*6)核(細胞核)
細胞内の染色体、遺伝情報の保存、管理、遺伝子発現の制御を行う場。
*7)分子シャペロン
タンパク質の折り畳み(フォールディング)を助けるタンパク質の総称。「シャペロン」とはフランス語で若い女性が社交界デビューする際、付き添う介添人の意味があり、タンパク質が成熟するのを助ける。
*8)恒常性
生物においては、周りの環境に作用されず、生体の状態が一定に保たれる性質。
*9)オートファジー
プロテアソームとともに細胞内のタンパク質を分解するための重要な機構。異常なタンパク質や、ユビキチン化タンパク質を分解し、過剰な蓄積を防ぐ。
*10)アグリソーム
異常なタンパク質凝集体形成の場。微小管とダイニン依存的に形成されることから、制御された機構である。細胞保護的な機能があると考えられている。
*11)小胞体
網目状に連なる膜性の細胞小器官で、細胞内のカルシウムの貯蔵のほか、分泌タンパク質のフォールディングや修飾、脂質代謝、細胞内物質輸送などを担う。
*12)ミトコンドリア
酸素呼吸の場として働く細胞内小器官。
*13)疎水性領域
タンパク質が持つ水になじまない領域で、細胞内で疎水性領域同士は会合しやすい。細胞内で生じた異常タンパク質は疎水性部分を分子表面に露出し、タンパク質凝集体形成や、細胞毒性を発揮すると考えられている。
*14)凝集体(タンパク質凝集体)
疎水性領域を分子表面に露出したタンパク質が本来の機能に反して、凝集したもの。神経変性疾患の原因となるタンパク質など凝集しやすいこと、凝集したタンパク質は細胞内で毒性を発揮することが知られている。
論文情報
タイトル
Nuclear export of ubiquitinated proteins via the UBIN-POST system.
(和文タイトル)UBIP-POST系によるユビキチン化タンパク質の核外排出
(和文タイトル)UBIP-POST系によるユビキチン化タンパク質の核外排出
著者名
Shoshiro Hirayama, Munechika Sugihara, Daisuke Morito, Shun-ichiro Iemura, Tohru Natsume, Shigeo Murata, Kazuhiro Nagata
掲載誌
Proceedings of the National Academy of Sciences, USA
- お問い合わせ先
-
京都産業大学 研究機構
〒603-8555 京都市北区上賀茂本山
Tel.075-705-1468
kenkyu-sho@star.kyoto-su.ac.jp
